Resumo
Fundamento:
Na menopausa, há maior exposição celular ao estresse oxidativo, relacionada à diminuição dos efeitos antioxidantes do estrogênio. Essas alterações metabólicas favorecem a progressão das doenças cardiovasculares, como a aterosclerose. A função anormal da aorta - a artéria mais importante - está associada a muitas doenças cardiovasculares. O colágeno, especialmente os tipos I e III, é um dos mais importantes componentes da parede da aorta e pode ser afetado por muitos fatores, incluindo a menopausa. Por sua vez, 8-OHdG é um dos principais marcadores de danos oxidativos do DNA induzidos por espécies reativas de oxigênio (EROS).
Objetivo:
Investigar os efeitos do treinamento aeróbico moderado na aorta ascendente de camundongos fêmeas, nocaute para LDL (LDL-KO) e ovariectomizadas.
Métodos:
Um total de 15 animais C57BL/6 e 15 animais LDL-KO foram divididos em grupos experimentais. A espessura e a densidade de volume das fibras de colágeno tipos I e III foram realizadas por análise morfoquantitativa; MMP-2 e MMP-9 e 8-OHdG foram detectadas por imunohistoquímica; e a apoptose foi detectada pelo ensaio TUNEL. O nível de significância adotado para todos os testes realizados foi p < 0,05.
Resultados:
o exercício causa aumento da espessura da aorta em grupos LDL-KO, particularmente acentuada em grupos ovariectomizados. As fibras de colágeno de tipo I mostraram aumento da densidade de volume influenciado pelo treinamento em animais controle e LDL-KO. A densidade do colágeno tipo III diminuiu em ambos os grupos. A MMP-2 mostrou imunomarcação moderada na túnica média em animais LDL-KO; em grupos controle, a MMP-9 marcou irregularmente em todos os tecidos. O marcador 8-OHdG foi mais forte nos grupos de treinamento de exercícios. Além disso, a ovariectomia, o treinamento físico e os tratamentos de LDL-KO aumentaram a apoptose.
Conclusão:
Esses resultados sugerem que exercícios aeróbicos de intensidade moderada em camundongos ovariectomizados associados ao aumento da taxa de LDL, possivelmente, aumentam o estresse oxidativo e a indução da apoptose.
Palavras-chave:
Ratos; Doenças Cardiovasculares; Menopausa; Colágenos Fibrilares/análise; Ovariectomia; Exercício; LDL-Colesterol
Abstract
Background:
In menopause, there is greater cellular exposure to oxidative stress, related to the decreased antioxidative effects of estrogen. These metabolic changes favor the progression of cardiovascular diseases, such as atherosclerosis. Abnormal function of the aorta - the most important artery - is associated with many cardiovascular diseases. Collagen, especially types I and III, is one of the most important aortic wall components and it can be affected by many factors, including menopause. The 8-OHdG is one of the main markers of DNA oxidative damage induced by reactive oxygen species (ROS).
Objective:
We aimed to investigate effects of moderate aerobic training on the ascending aorta of LDL-knockout (LDL-KO) and ovariectomized female mice.
Methods:
A total of 15 C57BL/6 mice and 15 LDL-KO mice were divided into experimental groups. The thickness and volume density of types I and III collagen fibers were performed by morphoquantitative analysis, whereas the MMP-2 and MMP-9 and 8-OHdG were detected by immunohistochemistry and apoptosis was detected by the TUNEL assay. The significance level for all tests was p < 0.05.
Results:
Exercise causes an increase in the thickness of the aorta in LDL-KO groups, particularly accentuated in the ovariectomized groups. The type I collagen fibers showed an increase in volume density influenced by training in both Control groups and in the LDL-KO group. Type III collagen density decreased in both groups. The MMP-2 showed moderade immunostaining in the tunica media in LDL-KO groups, which did not occur in the control groups and the MMP-9 stained irregularly in all tissues. The marker 8-OhdG was stronger in the exercise training groups. Additionally, the ovariectomy, the exercise training and the LDL-KO treatments increased apoptosis.
Conclusion:
These results suggest that moderate-intensity aerobic exercise in ovariectomized mice associated to an increase in LDL rate possibly increases oxidative stress and apoptosis induction.
Keywords:
Rats; Cardiovascuar Diseases; Menopause; Fibrillar Collagens/analysis; Ovariectomy; Exercise; Cholesterol, LDL
Introdução
A menopausa é um período durante o qual as mulheres sofrem alterações no perfil metabólico devido à diminuição da produção de hormônios como o estrogênio.11 Raskin P, Bode BW, Marks JB, Hirsch IB, Weinstein RL, McGill JB, et al. Continuous subcutaneous insulin infusion and multiple daily injection therapy are equally effective in type 2 diabetes: a randomized, parallel-group, 24-week study. Diabetes Care. 2003;26(9):2598-603.
2 De Lorenzi DRS, Basso E, Fagundes PO, Saciloto B. Prevalence of overweight and obesity among climacteric women. Rev Bras Ginecol Obstet. 2005;27(8):479-84.-33 Oliveira F, Maifrino LB, Jesus GP, Carvalho JG, Marchon C, Ribeiro DA. The role of cyclooxygenase-2 on endurance exercise training in female LDL-receptor knockout ovariectomized mice. An Acad Bras de Cienc. 2013;85(3):1157-64. Essas alterações metabólicas favorecem a progressão de doenças cardiovasculares, como a aterosclerose.44 Doshi SB, Agarwal A. The role of oxidative stress in menopause. J Midlife Health. 2013;4(3):140-6. A função anormal da aorta - a artéria mais importante - está associada a muitas doenças cardiovasculares. O colágeno, especialmente os tipos I e III, é um dos mais importantes componentes da parede da aorta e pode ser afetado por vários fatores, incluindo a menopausa.55 Berillis P. The role of collagen in the aorta’s structure. Open Circ Vasc J. 2013;6(1):1-8.
Exercícios físicos são recomendados para prevenção de doenças cardiovasculares durante a menopausa.66 Saltiki K, Doukas C, Kanakakis J, Anastasiou E, Mantzou E, Alevizaki M. Severity of cardiovascular disease in women: relation with exposure to endogenous estrogen. Maturitas. 2006;55(1):51-7.,77 Marchon C, de Marco OE, Silva VKA, Lacchini S, de Souza RR, Fonseca FL, et al. Effects of moderate exercise on the biochemical, physiological, morphological and functional parameters of the aorta in the presence of estrogen deprivation and dyslipidemia: an experimental model. Cell Physiol Biochem. 2015;35(1):397-405. No entanto, a atividade física de intensidade moderada a alta provoca aumento do estresse oxidativo em células e tecidos, elevando o risco de doença cardiovascular.88 Thompson P, Buchner D, Piña IL, Balady GJ, Williams MA, Marcus BH, et al. Exercise and physical activity in the prevention and treatment of atherosclerotic cardiovascular disease: a statement from the Council on Clinical Cardiology (Subcommittee on Exercise, Rehabilitation, and Prevention) and the Council on Nutrition, Physical Activity, and Metabolism (Subcommittee on Physical Activity). Councilon Clinical Cardiology Circulation. 2003;107(24):3109-16.
9 Goto C, Higashi Y, Kimura M, Noma K, Hara K, Nakagawa K, et al. Effect of different intensities of exercise on endothelium-dependent vasodilation in humans: role of endothelium-dependent nitric oxide and oxidative stress. Circulation. 2003;108(5):530-5.-1010 Silva JL, Maranhão RC, Vinagre M, Guilherme CG. Effects of resistance training on low density lipoprotein. Rev Bras de Med Esporte. 2010;16(1):71-6. A adaptação do corpo ao estresse oxidativo pode estar prejudicada em indivíduos com baixos níveis de estrogênio, que se liga a receptores celulares específicos e acelera a produção de vários antioxidantes pelas células.
Pouco se sabe sobre os efeitos da atividade física no desenvolvimento da aterosclerose e alterações metabólicas características da menopausa. Dados relevantes para a elucidação destes efeitos foram obtidos com o uso de marcadores como a 8-hidroxidesoxiguanosina (8-OHdG), metaloproteinases (MMPs), detecção de apoptose e quantificação de colágeno tipos III e I. A 8-OHdG é um dos principais marcadores de dano oxidativo do DNA induzido por espécies reativas de oxigênio (EROs).1111 Nishida N, Arizumi T, Takita M, Kitai S, Yada N, Hagiwara S, et al. Reactive oxygen species induce epigenetic instability though the formation of 8-Hydroxyguanosine in human hepatocarcinogenesis. Digestive Diseases 2013;31(5-6):459-66.,1212 Plachetka A, Adamek B, Strzelczyk JK, Krakowczyk Ł, Migula P, Nowak P, et al. 8-hidroxy-2’-deoxyguanosine in colorectal adenocarcinoma--is it a result of oxidative stress? Med Sci Monit. 2013 Aug 21;19:690-5. As MMPs desempenham papéis-chave na função de vários tecidos durante o crescimento, desenvolvimento e envelhecimento do organismo.1313 Carmeli E, Moas M, Reznick AZ, Coleman R. Matrix metalloproteinases and skeletal muscle: a brief review. Muscle Nerve. 2004;29(2):191-7.
14 Pasterkamp G, Schoneveld AH, Hijnen DJ, de Kleijn DP, Teepen H, van der Wal AC, et al. Atherosclerotic arterial remodeling and the localization of macrophages and matrix metalloproteases 1, 2 and 9 in the human coronary artery. Atherosclerosis. 2000;150(2):245-53.
15 Valentin F, Bueb JL, Kieffer P, Tschirhart E, Atkinson J. Oxidative stress activates MMP-2 in cultured human coronary smooth muscle cells. Fundam Clin Pharmacol. 2005;19(6):661-7.
16 Chow AK, Cena J, Schulz R. Acute actions and novel targets of matrix metalloproteinases in the heart and vasculature. Br J Pharmacol. 2007;152(2):189-205.-1717 Fanjul-Fernández M, Folgueras AR, Cabrera S, Lopez-Otin C. Matrix metalloproteinases: evolution, gene regulation and functional analysis in mouse models. Biochim Biophys Acta. 2010;1803(1):3-19. A atividade excessiva ou desequilibrada das MMPs está associada à patogênese de muitas doenças,1818 Galis ZS, Khatri JJ. Matrix metalloproteinases in vascular remodeling and atherogenesis: the good, the bad, and the ugly. Circ Res. 2002;90(3):251-62.,1919 Nagase H, Woessner JF. Matrix metalloproteinases. J Biol Chem. 1999;274:21491-4. dentre elas, doenças cardiovasculares, como a aterosclerose.2020 Tayebjee MH, Nadar S, Blann AD, Gareth BD, MacFadyen RJ, Lip GY. Matrix metalloproteinase-9 and tissue inhibitor of metalloproteinase-1 in hypertension and their relationship to cardiovascular risk and treatment: a substudy of the Anglo-Scandinavian Cardiac Outcomes Trial (ASCOT). Am J Hypertens. 2004;17(9):764-9.
A detecção de apoptose em tecidos é um marcador relacionado à lesão mitocondrial, à produção de EROs e ao estresse oxidativo. Na apoptose, a quebra do DNA resulta em vários fragmentos com terminais 3’-OH livres. A identificação das células submetidas ao processo de apoptose consiste em detectar enzimaticamente os terminais 3’-OH livres com a adição de nucleotídeos modificados pela enzima TdT (terminal desoxinucleotidil transferase).
Assim, nosso objetivo foi verificar os efeitos do treinamento aeróbio moderado na aorta ascendente de camundongos fêmeas nocaute para receptor de lipoproteína de baixa densidade - LDL e ovariectomizados.
Métodos
Animais e formação dos grupos
Os experimentos foram realizados em 15 camundongos fêmeas C57BL/6 e 15 camundongos fêmeas nocaute para receptor de lipoproteína de baixa densidade (LDL-KO), pesando 20-25 g, doo Biotério da Universidade São Judas Tadeu, São Paulo, Brasil. Os camundongos receberam a ração padrão de laboratório e água ad libitum. Os animais foram colocados em gaiolas em uma sala com temperatura controlada (22°C) e ciclo claro-escuro de 12 horas. Todos os procedimentos e protocolos cirúrgicos foram aprovados pelo Comitê do Uso Experimental de Animais da Universidade São Judas Tadeu (058/2007). Após uma randomização simples, os camundongos foram divididos em seis grupos (n = 5): controle sedentário (CS), controle sedentário ovariectomizado (CSO), controle treinado ovariectomizado (CTO), LDL KO sedentário (S-LDL KO), LDL KO sedentário ovariectomizado (SO-LDL KO) e LDL KO treinado ovariectomizado (TO-LDL KO). Os animais foram separados fisicamente e aleatoriamente entre os grupos/caixas.
A definição do tamanho da amostra foi realizada segundo dados anteriores de outros autores,2121 Rodrigues FM, Adélio JI, Santana VO, De Marco OE, Souza RR, Cardoso CG, et al. Physical exercise alters hepatic morphology of low-density lipoprotein receptor knockout ovariectomized mice. Med Mol Morphol. 2018 Jun 22; [Epub ahead of print].
22 Veloso AGB, Lima NEA, De Marco OE, Cardoso CG, Marques MR, Reis BCAA, et al. Effects of moderate exercise on biochemical, morphological, and physiological parameters of the pancreas of female mice with estrogen deprivation and dyslipidemia. Med Mol Morphol. 2018;51(2):118-27.-2323 Maifrino LBM, Araújo RC, Faccini CC, Liberti EA, Gama EF, Ribeiro AACM, et al. Effect of exercise training on aging-induced changes in rat papillary muscle. Arq Bras Cardiol. 2009;92(5):387-92. baseada nas recomendações da Instrução Normativa nº 27 do CONCEA (Conselho Nacional de Controle de Experimentação Animal) e determinada pela fórmula n = (2α / 2δ) 2 / E,2424 Triola MF. Introdução à estatística. 7. ed. Rio de Janeiro: LTC; 1999. onde n representa o tamanho da amostra; (2α)22 De Lorenzi DRS, Basso E, Fagundes PO, Saciloto B. Prevalence of overweight and obesity among climacteric women. Rev Bras Ginecol Obstet. 2005;27(8):479-84. representa um valor crítico que corresponde ao grau de confiança desejado, δ representa o desvio padrão da população e E representa a margem de erro (diferença entre a média da amostra e a média da população verdadeira).
Ovariectomia
Aos nove meses de idade, os animais foram anestesiados (cetamina 120 mg/kg + xilazina 20 mg/kg), e uma pequena incisão abdominal foi realizada, onde os ovários e ovidutos foram encontrados, seccionados e removidos. Em seguida, a pele e a parede muscular foram suturadas.2525 Marsh MM, Walker VR, Curtiss LK, Banka CL. Protection against atherosclerosis by estrogen is independent of plasma cholesterol levels in LDL receptor-deficient mice. J Lipid Res. 1999;40(5):893-900.,2626 Irigoyen MC, Paulini J, Flores LJ, Flues K, Bertagnolli M, Moreira ED, et al. Exercise training improves baroreflex sensitivity associated with oxidative stress reduction in ovariectomized rats. Hypertension. 2005;46(4):998-1003. A eficácia da ovariectomia foi determinada pela observação das secreções vaginais durante quatro dias consecutivos.
Protocolo de treinamento
Sete dias após a ovariectomia, todos os animais foram adaptados na esteira por dez minutos durante três dias antes de iniciar o treinamento. O teste de esforço máximo foi realizado em todos os grupos no início e no final do programa de treinamento, fornecendo a base para a prescrição do treinamento físico e com o objetivo de avaliar a capacidade física dos animais treinados.
Os grupos treinados foram submetidos a um protocolo de treinamento físico moderado em esteira ergométrica, com velocidade e carga progressivas (1 hora ao dia / 5 dias por semana a 50-60% da velocidade máxima de esforço) durante 4 semanas, conforme descrito anteriormente.2727 Desai KH, Sato R, Schauble E, Barsh GS, Kobilka BK, Bernstein D. Cardiovascular indexes in the mouse at rest and with exercise: new tools to study models of cardiac disease. Am J Physiol Heart Circ Physiol. 1997;272(2 Pt 2):H1053-61.
Procedimentos histológicos
Ao final do experimento, os animais foram pesados e subsequentemente submetidos a eutanásia por decapitação. A toracotomia foi realizada cortando-se a aorta ascendente na base do coração. As amostras da aorta foram lavadas (PBS - solução salina tamponada com fosfato 0,1M, pH 7,4) e fixadas em formaldeído a 10% por 24 horas. Eles então foram desidratadas, limpas e embebidas em parafina. A aorta foi seccionada transversalmente (5µm de espessura), e as amostras foram coradas com H&E para análise histomorfométrica.77 Marchon C, de Marco OE, Silva VKA, Lacchini S, de Souza RR, Fonseca FL, et al. Effects of moderate exercise on the biochemical, physiological, morphological and functional parameters of the aorta in the presence of estrogen deprivation and dyslipidemia: an experimental model. Cell Physiol Biochem. 2015;35(1):397-405. Para analisar os efeitos do treinamento aeróbico na aorta inteira, a túnica íntima não foi separada da túnica média. A coloração de Picrosirius foi utilizada para classificação das fibras de colágeno I e III. As imagens foram capturadas em 4 pontos, a 0º, 90º, 180º e 270º, com ampliação de 10x para medir a espessura da aorta e 40x para outras avaliações, e transferidas para um programa de análise de imagens (Axion Visio Software, Zeiss®). Para analisar a densidade volumétrica das fibras colágenas tipos I e III, as imagens foram obtidas em microscópio ótico com luz polarizada, analisadas em sistema teste de 252 pontos, e os valores expressos em porcentagens.
Análise imunohistoquímica: 8-OHdG, MMP-2 e MMP-9
Cinco seções transversais de 4 µm, montadas em lâminas previamente silanizadas, foram utilizadas para demonstrar a expressão de 8-OHdG, MMP-2 e MMP-9. As lâminas foram então desparafinizadas, limpas, hidratadas e lavadas em água corrente. Em seguida, a atividade da peroxidase endógena foi bloqueada com peróxido de hidrogênio a 0,3%, o bloqueio de proteínas foi realizado com leite desnatado a 0,3% diluído em PBS e as lâminas foram incubadas durante a noite com anticorpo primário anti-8-OHdG (SC66036 Santa Cruz® Biotechnology, CA, EUA), titulado a 1:100 e MMP2/72KDa e MMP9/KDa (SC-10436 Santa Cruz® Biotechnology, CA, EUA; SC-6840 Santa Cruz® Biotechnology, CA, EUA),titulado a 1: 150 em PBS-BSA 0,1%. Todas as lâminas foram então colocadas numa câmara úmida a 4°C durante a noite.
O material foi lavado com tampão PBS e incubado com anticorpo secundário biotinilado. Para revelação, o substrato cromogênico 3-3’ diaminobenzidina foi utilizado na proporção de 0,06 g por 100 mL de PBS, e 1 mL de H2O2 a 20 volumes por cinco minutos a 37 °C e contra-corado com hematoxilina de Mayer por 3 minutos. Finalmente, as lâminas foram montadas com lamínula e Entellan® para análise sob microscopia ótica.
Investigação da morte celular por apoptose pelo método imunocitoquímico de TUNEL
A coloração TUNEL (Terminal deoxynucleotidyl transferase dUTP nick end labeling) foi realizada utilizando-se o kit ApopTag Peroxidase In Situ Apoptosis Detection (Millipore®, Alemanha) de acordo com as instruções do fabricante.
Quantificação de células apoptóticas
Para a quantificação das células imunomarcadas para apoptose, foram capturadas 30 imagens da camada íntima-média (10 imagens/animal; n = 3 animais/grupo), com aumento de 10x para medir a espessura da aorta e 40x para outras avaliações, e transferidas para um programa de análise de imagens (Axion Visio Software, Zeiss®) para cada grupo experimental.
Para cada imagem, o número total de células imunomarcadas foi obtido como uma frequência relativa (%) em relação ao número total de células. O microscópio ótico acoplado a uma câmera digital (Zeiss, Alemanha) foi utilisado para obter as imagens, e as fotomicrografias foram digitalizadas com o software AxioVision (Zeiss®, Alemanha).
Análise estatística
Os resultados foram apresentados como média e desvio padrão. A análise de variância (ANOVA) e os testes post-hoc de Tukey foram aplicados adequadamente na análise dos dados. O nível de significância para todos os testes foi de p < 0,05. Os dados foram avaliados utilizando-se o software Stata 7.0. Todas as variáveis contínuas estavam distribuídas normalmente (teste de Shapiro-Wilk). Para avaliar a normalidade dos dados, foi utilizado o cálculo de Shapiro-Wilk, que mostrou que os dados estavam alocados dentro da curva de Gauss. Considerando-se um nível de significância de 5%, o teste assumiu a hipótese de normalidade para a variável com distribuição normal.
Resultados
Análise histopatológica e histomorfométrica
A análise histopatológica mostrou que os animais dos grupos controle (CS, CSO e CTO) não apresentaram alterações no arranjo das fibras elásticas e no padrão de espessura. No entanto, os grupos dislipidêmicos (S-LDL KO, SO-LDL KO e TO-LDL KO) apresentaram maior espaçamento entre as fibras elásticas (Figura 1).
Cortes transversais de aorta do camundongo mostrando o arranjo das fibras elásticas. Os grupos controle mostraram um padrão similar de arranjo e espessura das fibras elásticas. Os grupos LDL KO mostraram fibras mais espaçadas e paredes dos vasos mais espessas em comparação com os controles. Fotomicrografias, H&E. Barra de Calibração = 100 µm. Controle sedentário (CS), controle sedentário ovariectomizado (CSO), controle treinado ovariectomizado (CTO), grupo sedentário LDL KO (S-LDL KO), grupo sedentário ovariectomizado LDL KO (SO-LDL KO) e grupo treinado ovariectomizado LDL KO (TO-LDL KO).
Espessura da túnica íntima-média (µm)
Observamos um aumento significativo na espessura da túnica íntima-média em animais dislipidêmicos, quando comparados aos animais dos grupos controle. A ovariectomia e o exercício nos grupos LDL KO foram determinantes para o aumento dessa variável. Tanto no grupo controle quanto no grupo LDL KO o exercício de treinamento não reverteu esse processo (Figuras 1 e 2).
Espessura da túnica íntima-média (µm) nos grupos estudados. Os valores são expressos como M ± DP * p < 0,05 vs. S-C; #p < 0,05 vs. OS-C; + p < 0,05 vs. OT-C; < p < 0,05 vs S-LDL KO; 2p < 0,05 vs OS-LDL KO.
Densidade de volume das fibras de colágeno tipos I e III na túnica íntima-média e adventícia
Comportamento semelhante da fibra de colágeno tipo III foi observado entre a túnica íntima-média e a adventícia. Observamos uma diminuição significativa na densidade de volume da fibra de colágeno tipo III nos grupos LDL KO, quando comparados com o CS (Figura 3).
Densidade de volume das fibras de colágeno tipos I e III (Vv [fc]) na Túnica íntima-média e na adventícia da aorta ascendente. Os valores são expressos como M ± DP. *p < 0,05 vs. CS; #p < 0,05 vs. CSO; + p < 0,05 vs. STO.
As fibras de colágeno tipo I da túnica adventícia e da íntima-média apresentaram aumento na densidade de volume, influenciado pelo treinamento nos grupos Controle. A dislipidemia induz a um aumento das fibras de colágeno tipo I nos grupos LDL KO quando comparado aos grupos Controle e não sofreram nenhuma alteração causada pela ovariectomia ou pelo treinamento (Figura 3).
Análise imunohistoquímica
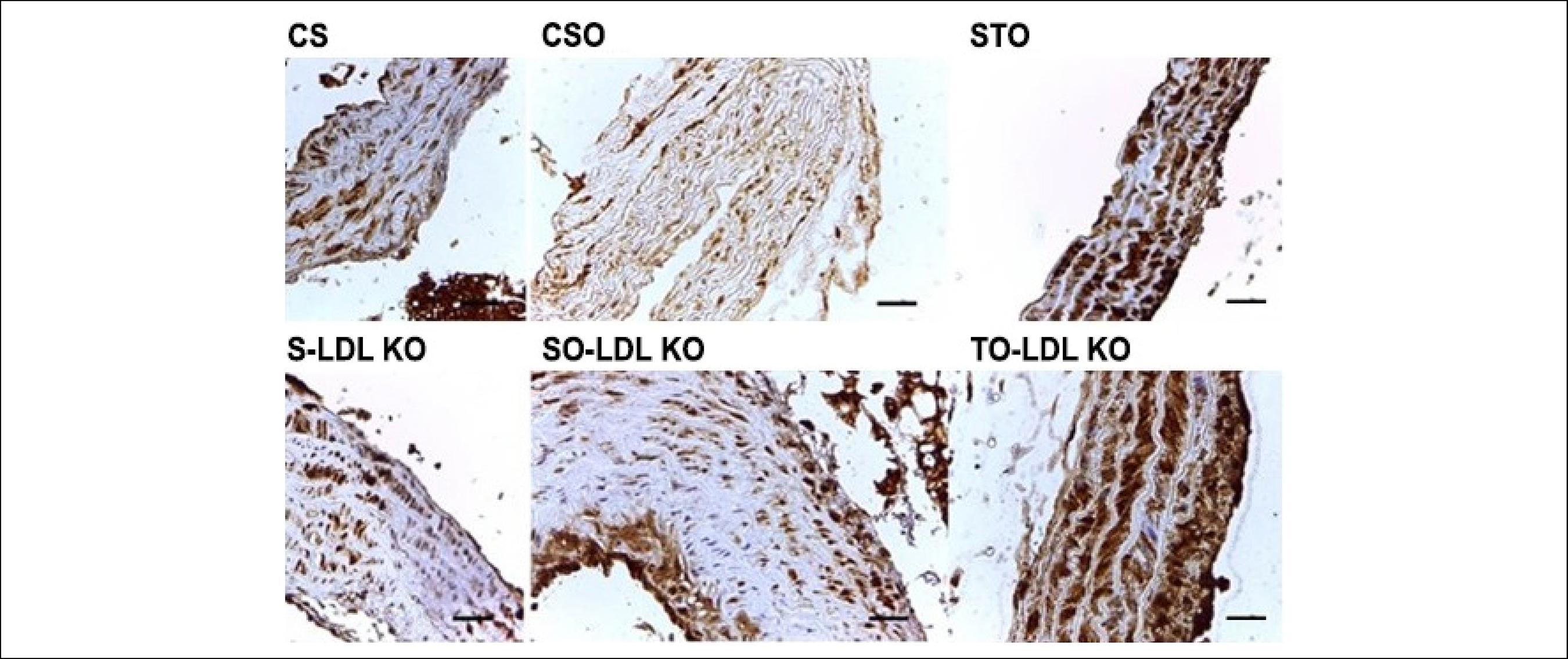
A Figura 4 mostra a coloração do tecido causada pelo marcador de estresse oxidativo 8-OHdG. Observe que a imunoexpressão do marcador ocorreu em todos os grupos. A coloração foi moderada para os grupos LDL KO e Controle, tanto Sedentário quanto Ovariectomizado. No entanto, para os grupos Ovariectomizados e treinados, a coloração observada foi intensa.
Fotomicrografias de cortes transversais da aorta de camundongos submetidos à reação imuno-histoquímica para 8-OHdG. A imunoexpressão de 8-OHdG foi observada em todos os grupos investigados. A coloração foi moderada para os grupos LDL KO e Controle, tanto o S como o SO. No entanto, para os grupos O e T, a coloração observada foi intensa. Barra de calibração = 100µm.
Em todos os grupos controle (CS, CSO e CTO), a imunoexpressão de MMP-2 ocorreu tanto na túnica íntima (seta) quanto na adventícia (cabeça de seta) da aorta ascendente. Os grupos LDL, em geral, mostraram imunoexpressão da MMP-2 além das túnicas íntima e adventícia, mas também na túnica média da aorta (embora muito levemente), o que não foi observado em nenhum grupo de animais controle (Figura 5). A MMP-9 foi expressa em todas as camadas da aorta ascendente de todos os grupos; no entanto, a distribuição foi heterogênea (Figura 6).
Fotomicrografias de cortes transversais da aorta ascendente de camundongos submetidos a reação imunohistoquímica para MMP-2. Observe a presença de imunoexpressão para MMP-2 nas camadas íntima (seta) e adventícia (cabeça de seta) em todos os grupos de controle (CS, CSO e CTO). Em geral, a imunoexpressão de MMP-2 nos grupos LDL KO foi observada nas camadas íntima e adventícia, bem como na camada média da aorta (*), o que não ocorreu em nenhum animal dos grupos controle. Barra de calibração: 100 µm
Fotomicrografias de cortes transversais da aorta ascendente de camundongos submetidos a reação imuno-histoquímica para MMP-9. Observe a presença de imunoexpressão em todas as camadas, de forma heterogênea, em todos os grupos. Barra de calibração: 100 µm.
Células apoptóticas estavam distribuídas na camada íntima-média da aorta ascendente em todos os grupos estudados. A comparação da frequência relativa mostrou que a ovariectomia aumentou estatisticamente a apoptose em + 12,6% no grupo sedentário (CSO) e + 19% no grupo treinamento físico (CTO) quando comparado à apoptose do grupo CS (Figura 7). Entre os grupos nocaute, as taxas de apoptose foram maiores que os respectivos controles, independentemente se os camundongos fossem ovariectomizados ou não. Assim, o CSO nocaute apresentou aumento da frequência de apoptose em + 28,8% quando comparado ao grupo controle. A ovariectomia e nocaute aumentaram estatisticamente a apoptose em +24,5% nos grupos sedentário (SO-LDL KO) e + 32,3% no treinamento físico (TO-LDL KO), quando comparados ao grupo CS. Nenhuma mudança significativa foi observada quando se comparou o grupo sedentário nocaute (S-LDL-KO) com os grupos nocaute sedentário ovariectomizados (SO-LDL KO) ou com treinamento físico (TO-LDL KO), com diminuição da apoptose em -4,3% e melhora apoptose em + 3,5%, respectivamente. No entanto, a frequência relativa de grupos nocaute com ovariectomia, sedentarismo e treinamento físico mostrou-se estatisticamente aumentada em +7,8% (Figura 7).
Frequência relativa (%) de células apoptóticas na aorta ascendente do grupo controle sedentário (CS) versus os diferentes grupos avaliados, conforme evidenciado pelo ensaio TUNEL. * p < 0,05 vs. CS, # p < 0,05 vs. CSO, + p < 0,05 vs. SO-LDL-KO. Os valores são expressos como média ± DP (p < 0,05).
Discussão
O principal objetivo desse estudo foi verificar os efeitos do treinamento aeróbico moderado na aorta ascendente de camundongos ovariectomizados, nocaute para o receptor de lipoproteína de baixa densidade - LDL, através da análise de fibras de colágeno tipos I e III, a expressão de 8-OHdG e marcadores de estresse oxidativo das MMP-2 e MMP-9.
O colágeno e a elastina são importantes componentes estruturais e funcionais da parede arterial. Esses componentes participam ativamente do remodelamento da parede arterial em resposta a alterações hemodinâmicas e durante a aterogênese.
A análise histopatológica não mostrou alterações morfológicas no grupo controle. No entanto, o grupo LDL KO apresentou maior espessura e maior espaçamento entre as fibras elásticas. Alguns estudos demonstraram uma associação entre o aumento da espessura intima-média e a ocorrência de eventos cardíacos,2828 Corrado E, Rizzo M, Tantillo R, Muratori I, Bonura F, Vitale G, et al. Markers of inflammation and infection influence the outcome of patients with baseline symptomatic carotid lesions: a 5-year follow-up study. Stroke. 2006;37(2):482-6. o que confirmou a existência da associação entre o aumento da espessura intima-média da carótida e a presença de fatores de risco cardiovascular, incluindo marcadores de infecção e inflamação. O colágeno I é principalmente um colágeno estrutural; o colágeno III, por sua vez, é mais frequente em processos patológicos. Nossos resultados mostraram que o número de células em apoptose foi significativamente menor no grupo controle e se manteve constante nos grupos Controle (CSO e CTO) e nos grupos nocaute LDL (S-LDL KO, SO-LDL KO e TO-LDL KO), sem diferenças significativas na porcentagem de células apoptóticas entre os grupos controle ou nocaute LDL para cada parâmetro utilizado. No entanto, o processo de apoptose foi maior nos animais dos grupos nocaute LDL, quando comparados aos animais dos grupos controle, independentemente de terem sido ovariectomizados ou não. Isso sugere que a ovariectomia não foi um fator importante nos processos de indução de apoptose na aorta.
Os altos níveis de LDL na corrente sanguínea podem ter sido o fator indutor de apoptose no endotélio e na túnica média da aorta ascendente nos grupos nocaute LDL. A disfunção endotelial induzida pela oxidação da LDL (ox-LDL) tem sido associada à patogênese da aterosclerose e outros distúrbios vasculares. Sabe-se que a LDL-ox ativa a liberação de EROs e tem sido associada a apoptose e dano ao endotélio.2929 Qin B, Cao Y, Yang H, Xiao B, Lu Z. MicroRNA-221/222 regulate ox-LDL-induced endothelial apoptosis via Ets-1/p21 inhibition. Mol Cell Biochem. 2015;405(1-2):115-24. A apoptose de células musculares lisas vasculares (CMLV) está associada à ocorrência de doenças vasculares. Na aterosclerose, a indução da apoptose celular tem sido associada à ruptura da placa aterosclerótica, coagulação, remodelação vascular, atrofia da túnica média, à formação de aneurismas e calcificação.3030 Littlewood TD, Bennett MR. Apoptotic cell death in atherosclerosis. Curr Opin Lipidol. 2003;14(5):469-75. Além disso, em várias doenças humanas, como a síndrome de Marfan e a necrose cística da túnica média (NCM), os processos apoptóticos resultam em maior quebra das fibras elásticas, deposição anormal da matriz extracelular e expansão da túnica média.3131 Clarke MC, Littlewood TD, Figg N, Maguire JJ, Davenport AP, Goddard MR, et al. Chronic apoptosis of vascular smooth muscle cells accelerates atherosclerosis and promotes calcification and medial degeneration. Circ Res. 2008;102(12):1529-38. Nesse ambiente, a liberação de interleucina IL-1α e IL-8, assim como a expressão da proteína quimioatrativa de monócitos (MCP-1) ocorre durante a apoptose de CMLV, que causa infiltração de macrófagos in vivo, aumentando o dano tecidual observado.3232 Schaub FJ, Han DK, Liles WC, Adams LD, Coats SA, Ramachandran RK, et al. Fas/FADD-mediated activation of a specific program of inflammatory gene expression in vascular smooth muscle cells. Nat Med. 2000;6(7):790-6.
Os animais do grupo CTO apresentaram maior número de células apoptóticas em relação aos grupos CSO e CS (p < 0,05). A atividade física tem sido associada ao aumento dos níveis de apoptose em timócitos de ratos, músculo esquelético e linfócitos de camundongos.3333 Sandri M, Carraro U, Podhorska-Okolov M, Rizzi C, Arslan P, Monti D, et al. Apoptosis, DNA damage and ubiquitin expression in normal and mdx muscle fibers after exercise. FEBS Lett. 1995;373(3):291-5.,3434 Goon JA, Noor Aini AH, Musalmah M, Yasmin Anum MY, Wan Ngah WZ. Long term Tai Chi exercise reduced DNA damage and increased lymphocyte apoptosis and proliferation in older adults. Med J Malaysia. 2008;63(4):319-24. O estresse oxidativo resultante do metabolismo em atividades físicas tem sido amplamente associado com a apoptose. Em pacientes com doenças cardiovasculares, a deficiência na produção do óxido nítrico (NO), associada ao estresse oxidativo, resulta em um declínio da biodisponibilidade do NO, induzindo a apoptose das células endoteliais e, consequentemente, resultando em disfunção endotelial.3535 Mangge H, Becker K, Fuchs D, Gostner JM. Antioxidants, inflammation and cardiovascular disease. World J Cardiol. 2014;6(6):462-77. Os animais ovariectomizados apresentaram maior porcentagem de células apoptóticas do que os grupos controle treinados e sedentários (CTO e CSO). Isso sugere que a diminuição da produção de hormônios pode estar relacionada à redução dos efeitos antioxidantes no organismo.
O 8-OHdG é um dos principais produtos oxidativos do DNA, que é considerado um marcador confiável de danos oxidativos ao DNA. Assim, o 8-OHdG tem sido amplamente utilizado como um biomarcador sensível de estresse oxidativo.3636 Xiang F, Shuanglun X, Jingfeng W, Ruqiong N, Yuan Z, Yongqing L, et al. Association of serum 8-hydroxy-2’-deoxyguanosine levels with the presence and severity of coronary artery disease. Coron Artery Dis. 2011;22(4):223-7. A análise imunohistoquímica do 8-OHdG mostrou coloração em todos os grupos; no entanto, os grupos treinados apresentaram maior intensidade de coloração. Goto et al.,99 Goto C, Higashi Y, Kimura M, Noma K, Hara K, Nakagawa K, et al. Effect of different intensities of exercise on endothelium-dependent vasodilation in humans: role of endothelium-dependent nitric oxide and oxidative stress. Circulation. 2003;108(5):530-5. em 2003, descobriram que o exercício de alta intensidade aumenta os níveis de 8-OHdG no plasma, o que explica o maior grau de coloração nos grupos treinados.
Houve diferenças na expressão de MMP-2, e o grupo controle mostrou coloração nas camadas íntima e adventícia, enquanto o grupo LDL KO mostrou coloração na camada média. De acordo com Sakalihasan et al.,3737 Sakalihasan N, Delvenne P, Nusgens BV, Limet R, Lapière CM. Activated forms of MMP2 and MMP9 in abdominal aortic aneurysms. J Vasc Surg. 1996;24(1):127-33. em 1996, isso ocorre porque a lesão aterosclerótica causa a migração da MMP-2 nas extremidades e em menor quantidade no tecido normal, para a camada média, ou seja, a formação de placas ateroscleróticas ativa um conjunto de reações em cadeia, o que pode aumentar a quantidade de MMP-2 presente no tecido. Com relação à expressão da MMP-9, todos os grupos apresentaram coloração tecidual, mas sem um padrão. Nenhuma evidência foi encontrada que explicasse essa coloração heterogênea.
Conclusão
O modelo experimental analisado mostra alterações histomorfométricas com aumento da expressão de 8-OHdG nos grupos treinados. Um aumento na taxa de apoptose foi observado nos grupos treinados e no grupo ovariectomizado LDL KO. Os grupos corados com MMP-2 mostraram migração e aumento de expressão na túnica média dos grupos LDL KO. No entanto, a coloração de MMP-9 apareceu em todos os grupos, mas não seguiu um padrão homogêneo. Por fim, estudos sobre a expressão de MMPs em tecidos musculares cardíacos com aterosclerose são muito escassos, sugerindo a necessidade de mais estudos para investigar o assunto. Assim, os resultados aqui descritos sugerem que o exercício aeróbico de intensidade moderada em camundongos ovariectomizados, associado a um aumento nas taxas de LDL, possivelmente aumenta o estresse oxidativo e a indução de apoptose.
A avaliação dos parâmetros em estudo (MMPs, apoptose e 8-OHdG) foi realizada por imunohistoquímica. No entanto, outras tecnologias mais sensíveis (como as de biologia molecular) poderiam ser utilizadas nessas avaliações, levando a resultados e interpretações mais precisos.
-
Fontes de financiamentoO presente estudo não teve fontes de financiamento externas.
-
Vinculação acadêmicaNão há vinculação deste estudo a programas de pós-graduação.
-
Aprovação ética e consentimento informadoEste estudo foi aprovado pela Comissão de Ética em Experimentação Animal da Universidade de São Judas Tadeu sob o número de protocolo 058/2007.
References
-
1Raskin P, Bode BW, Marks JB, Hirsch IB, Weinstein RL, McGill JB, et al. Continuous subcutaneous insulin infusion and multiple daily injection therapy are equally effective in type 2 diabetes: a randomized, parallel-group, 24-week study. Diabetes Care. 2003;26(9):2598-603.
-
2De Lorenzi DRS, Basso E, Fagundes PO, Saciloto B. Prevalence of overweight and obesity among climacteric women. Rev Bras Ginecol Obstet. 2005;27(8):479-84.
-
3Oliveira F, Maifrino LB, Jesus GP, Carvalho JG, Marchon C, Ribeiro DA. The role of cyclooxygenase-2 on endurance exercise training in female LDL-receptor knockout ovariectomized mice. An Acad Bras de Cienc. 2013;85(3):1157-64.
-
4Doshi SB, Agarwal A. The role of oxidative stress in menopause. J Midlife Health. 2013;4(3):140-6.
-
5Berillis P. The role of collagen in the aorta’s structure. Open Circ Vasc J. 2013;6(1):1-8.
-
6Saltiki K, Doukas C, Kanakakis J, Anastasiou E, Mantzou E, Alevizaki M. Severity of cardiovascular disease in women: relation with exposure to endogenous estrogen. Maturitas. 2006;55(1):51-7.
-
7Marchon C, de Marco OE, Silva VKA, Lacchini S, de Souza RR, Fonseca FL, et al. Effects of moderate exercise on the biochemical, physiological, morphological and functional parameters of the aorta in the presence of estrogen deprivation and dyslipidemia: an experimental model. Cell Physiol Biochem. 2015;35(1):397-405.
-
8Thompson P, Buchner D, Piña IL, Balady GJ, Williams MA, Marcus BH, et al. Exercise and physical activity in the prevention and treatment of atherosclerotic cardiovascular disease: a statement from the Council on Clinical Cardiology (Subcommittee on Exercise, Rehabilitation, and Prevention) and the Council on Nutrition, Physical Activity, and Metabolism (Subcommittee on Physical Activity). Councilon Clinical Cardiology Circulation. 2003;107(24):3109-16.
-
9Goto C, Higashi Y, Kimura M, Noma K, Hara K, Nakagawa K, et al. Effect of different intensities of exercise on endothelium-dependent vasodilation in humans: role of endothelium-dependent nitric oxide and oxidative stress. Circulation. 2003;108(5):530-5.
-
10Silva JL, Maranhão RC, Vinagre M, Guilherme CG. Effects of resistance training on low density lipoprotein. Rev Bras de Med Esporte. 2010;16(1):71-6.
-
11Nishida N, Arizumi T, Takita M, Kitai S, Yada N, Hagiwara S, et al. Reactive oxygen species induce epigenetic instability though the formation of 8-Hydroxyguanosine in human hepatocarcinogenesis. Digestive Diseases 2013;31(5-6):459-66.
-
12Plachetka A, Adamek B, Strzelczyk JK, Krakowczyk Ł, Migula P, Nowak P, et al. 8-hidroxy-2’-deoxyguanosine in colorectal adenocarcinoma--is it a result of oxidative stress? Med Sci Monit. 2013 Aug 21;19:690-5.
-
13Carmeli E, Moas M, Reznick AZ, Coleman R. Matrix metalloproteinases and skeletal muscle: a brief review. Muscle Nerve. 2004;29(2):191-7.
-
14Pasterkamp G, Schoneveld AH, Hijnen DJ, de Kleijn DP, Teepen H, van der Wal AC, et al. Atherosclerotic arterial remodeling and the localization of macrophages and matrix metalloproteases 1, 2 and 9 in the human coronary artery. Atherosclerosis. 2000;150(2):245-53.
-
15Valentin F, Bueb JL, Kieffer P, Tschirhart E, Atkinson J. Oxidative stress activates MMP-2 in cultured human coronary smooth muscle cells. Fundam Clin Pharmacol. 2005;19(6):661-7.
-
16Chow AK, Cena J, Schulz R. Acute actions and novel targets of matrix metalloproteinases in the heart and vasculature. Br J Pharmacol. 2007;152(2):189-205.
-
17Fanjul-Fernández M, Folgueras AR, Cabrera S, Lopez-Otin C. Matrix metalloproteinases: evolution, gene regulation and functional analysis in mouse models. Biochim Biophys Acta. 2010;1803(1):3-19.
-
18Galis ZS, Khatri JJ. Matrix metalloproteinases in vascular remodeling and atherogenesis: the good, the bad, and the ugly. Circ Res. 2002;90(3):251-62.
-
19Nagase H, Woessner JF. Matrix metalloproteinases. J Biol Chem. 1999;274:21491-4.
-
20Tayebjee MH, Nadar S, Blann AD, Gareth BD, MacFadyen RJ, Lip GY. Matrix metalloproteinase-9 and tissue inhibitor of metalloproteinase-1 in hypertension and their relationship to cardiovascular risk and treatment: a substudy of the Anglo-Scandinavian Cardiac Outcomes Trial (ASCOT). Am J Hypertens. 2004;17(9):764-9.
-
21Rodrigues FM, Adélio JI, Santana VO, De Marco OE, Souza RR, Cardoso CG, et al. Physical exercise alters hepatic morphology of low-density lipoprotein receptor knockout ovariectomized mice. Med Mol Morphol. 2018 Jun 22; [Epub ahead of print].
-
22Veloso AGB, Lima NEA, De Marco OE, Cardoso CG, Marques MR, Reis BCAA, et al. Effects of moderate exercise on biochemical, morphological, and physiological parameters of the pancreas of female mice with estrogen deprivation and dyslipidemia. Med Mol Morphol. 2018;51(2):118-27.
-
23Maifrino LBM, Araújo RC, Faccini CC, Liberti EA, Gama EF, Ribeiro AACM, et al. Effect of exercise training on aging-induced changes in rat papillary muscle. Arq Bras Cardiol. 2009;92(5):387-92.
-
24Triola MF. Introdução à estatística. 7. ed. Rio de Janeiro: LTC; 1999.
-
25Marsh MM, Walker VR, Curtiss LK, Banka CL. Protection against atherosclerosis by estrogen is independent of plasma cholesterol levels in LDL receptor-deficient mice. J Lipid Res. 1999;40(5):893-900.
-
26Irigoyen MC, Paulini J, Flores LJ, Flues K, Bertagnolli M, Moreira ED, et al. Exercise training improves baroreflex sensitivity associated with oxidative stress reduction in ovariectomized rats. Hypertension. 2005;46(4):998-1003.
-
27Desai KH, Sato R, Schauble E, Barsh GS, Kobilka BK, Bernstein D. Cardiovascular indexes in the mouse at rest and with exercise: new tools to study models of cardiac disease. Am J Physiol Heart Circ Physiol. 1997;272(2 Pt 2):H1053-61.
-
28Corrado E, Rizzo M, Tantillo R, Muratori I, Bonura F, Vitale G, et al. Markers of inflammation and infection influence the outcome of patients with baseline symptomatic carotid lesions: a 5-year follow-up study. Stroke. 2006;37(2):482-6.
-
29Qin B, Cao Y, Yang H, Xiao B, Lu Z. MicroRNA-221/222 regulate ox-LDL-induced endothelial apoptosis via Ets-1/p21 inhibition. Mol Cell Biochem. 2015;405(1-2):115-24.
-
30Littlewood TD, Bennett MR. Apoptotic cell death in atherosclerosis. Curr Opin Lipidol. 2003;14(5):469-75.
-
31Clarke MC, Littlewood TD, Figg N, Maguire JJ, Davenport AP, Goddard MR, et al. Chronic apoptosis of vascular smooth muscle cells accelerates atherosclerosis and promotes calcification and medial degeneration. Circ Res. 2008;102(12):1529-38.
-
32Schaub FJ, Han DK, Liles WC, Adams LD, Coats SA, Ramachandran RK, et al. Fas/FADD-mediated activation of a specific program of inflammatory gene expression in vascular smooth muscle cells. Nat Med. 2000;6(7):790-6.
-
33Sandri M, Carraro U, Podhorska-Okolov M, Rizzi C, Arslan P, Monti D, et al. Apoptosis, DNA damage and ubiquitin expression in normal and mdx muscle fibers after exercise. FEBS Lett. 1995;373(3):291-5.
-
34Goon JA, Noor Aini AH, Musalmah M, Yasmin Anum MY, Wan Ngah WZ. Long term Tai Chi exercise reduced DNA damage and increased lymphocyte apoptosis and proliferation in older adults. Med J Malaysia. 2008;63(4):319-24.
-
35Mangge H, Becker K, Fuchs D, Gostner JM. Antioxidants, inflammation and cardiovascular disease. World J Cardiol. 2014;6(6):462-77.
-
36Xiang F, Shuanglun X, Jingfeng W, Ruqiong N, Yuan Z, Yongqing L, et al. Association of serum 8-hydroxy-2’-deoxyguanosine levels with the presence and severity of coronary artery disease. Coron Artery Dis. 2011;22(4):223-7.
-
37Sakalihasan N, Delvenne P, Nusgens BV, Limet R, Lapière CM. Activated forms of MMP2 and MMP9 in abdominal aortic aneurysms. J Vasc Surg. 1996;24(1):127-33.
Datas de Publicação
-
Publicação nesta coleção
17 Dez 2018 -
Data do Fascículo
Fev 2019
Histórico
-
Recebido
09 Dez 2017 -
Revisado
04 Maio 2018 -
Aceito
23 Jul 2018