Resumos
RESUMO A fim de estabelecer um parâmetro para a avaliação da viabilidade após o descongelamento, os resultados do cultivo de embriões frescos de camundongos, no meio PBS Modificado sem a adição de C02, foram comparados aos resultados obtidos após o cultivo no meio de Whitten Modificado em atmosfera com 5% de C02. Foram coletadas 1458 mórulas provenientes de fêmeas Mus musculus da cepa Suíço Albina CF 1, previamente superovuladas com 6-8UI de eCG e 6-8UI de HCG, com intervalo de 48 horas. Destas, 1051 foram cultivadas em PBS Modificado acrescido de 20% de SFB, a 37°C e 95% de umidade. As restantes 407 foram cultivadas no meio de Whitten Modificado, acrescido de 3% de BSA, a 37°C, 95% de umidade e 5% de C02. As avaliações foram realizadas com 24h de cultivo, sendo considerados os embriões que atingiram os estágios de blastocisto inicial (Bi), blastocisto (Bl), blastocisto expandido (Bx), blastocisto em eclosão (Bh) ou blastocisto eclodido (Be), e após 48h de cultivo os que atingiram pelo menos o estágio de blastocisto expandido. Os resultados obtidos após 24h (87,9 e 89,4%) e após 48h de cultivo (95,1 e 93,8%) em PBS e Whitten respectivamente, não apresentaram diferenças estatisticamente significativas (p < 0,05).
meios de cultivo; camundongos; mórulas; tampão fosfato; tampão bicarbonato
SUMMARY The development of fresh mouse embryos in Modified PBS without adding C02 was compared to the development in Modified Whitten supplemented with 5% de C02 in order to establish a parameter to assess the viability after thawing. One thousand and four hundred and fifty eight morulae were collected from Strain CF1 Swiss Albino Mus musculus females which had been previously superovulated with 6-8UI of PMSG and 6-8UI of HCG 48h apart. One thousand and fifty one morulae were cultured in Modified PBS + 20% FCS, at 37°C and 95% of humidity. The others 407 were cultured in Modified Whitten's medium + 3% BSA, at 37 °C, 95% of humidity and 5% of C02. At the evaluation, performed after 24h of culture, were considered developed the embryos that reached early blastocyst, expanded blastocyst, hatching blastocyst and hatched blastocyts stages. After 48h of culture were considered developed the embryos that reached at least the expanded blastocyst stage. The results obtained after 24h (87.9 and 89.4%) and 48h of culture (95.2 and 93.8%) in PBS and Whitten, respectively, were similar (p < 0,05).
culture media; mouse; morulae; phosphate buffer; bicarbonate buffer
AVALIAÇÃO DOS MEIOS PBS E WHITTEN NO CULTIVO DE MORULAS DE Mus musculus1 1 Trabalho apresentado na IV Reunião Anual da Sociedade Brasileira de Transferência de Embriões, 4 e 5 de setembro, Porto Alegre, RS, 1989.
EVALUATION OF PBS AND WHITTEN MEDIA AT CULTURE OF Mus musculus MORULAE.
Mari Lourdes Bernardi2 1 Trabalho apresentado na IV Reunião Anual da Sociedade Brasileira de Transferência de Embriões, 4 e 5 de setembro, Porto Alegre, RS, 1989. Alceu Mezzalira2 1 Trabalho apresentado na IV Reunião Anual da Sociedade Brasileira de Transferência de Embriões, 4 e 5 de setembro, Porto Alegre, RS, 1989. Mara Iolanda Batistella Rubin3 1 Trabalho apresentado na IV Reunião Anual da Sociedade Brasileira de Transferência de Embriões, 4 e 5 de setembro, Porto Alegre, RS, 1989. Giovani Bertani4 1 Trabalho apresentado na IV Reunião Anual da Sociedade Brasileira de Transferência de Embriões, 4 e 5 de setembro, Porto Alegre, RS, 1989. Luiz Carlos Kreutz4 1 Trabalho apresentado na IV Reunião Anual da Sociedade Brasileira de Transferência de Embriões, 4 e 5 de setembro, Porto Alegre, RS, 1989.
RESUMO
A fim de estabelecer um parâmetro para a avaliação da viabilidade após o descongelamento, os resultados do cultivo de embriões frescos de camundongos, no meio PBS Modificado sem a adição de C02, foram comparados aos resultados obtidos após o cultivo no meio de Whitten Modificado em atmosfera com 5% de C02. Foram coletadas 1458 mórulas provenientes de fêmeas Mus musculus da cepa Suíço Albina CF 1, previamente superovuladas com 6-8UI de eCG e 6-8UI de HCG, com intervalo de 48 horas. Destas, 1051 foram cultivadas em PBS Modificado acrescido de 20% de SFB, a 37°C e 95% de umidade. As restantes 407 foram cultivadas no meio de Whitten Modificado, acrescido de 3% de BSA, a 37°C, 95% de umidade e 5% de C02. As avaliações foram realizadas com 24h de cultivo, sendo considerados os embriões que atingiram os estágios de blastocisto inicial (Bi), blastocisto (Bl), blastocisto expandido (Bx), blastocisto em eclosão (Bh) ou blastocisto eclodido (Be), e após 48h de cultivo os que atingiram pelo menos o estágio de blastocisto expandido. Os resultados obtidos após 24h (87,9 e 89,4%) e após 48h de cultivo (95,1 e 93,8%) em PBS e Whitten respectivamente, não apresentaram diferenças estatisticamente significativas (p < 0,05).
Palavras-chave: meios de cultivo, camundongos, mórulas, tampão fosfato, tampão bicarbonato.
SUMMARY
The development of fresh mouse embryos in Modified PBS without adding C02 was compared to the development in Modified Whitten supplemented with 5% de C02 in order to establish a parameter to assess the viability after thawing. One thousand and four hundred and fifty eight morulae were collected from Strain CF1 Swiss Albino Mus musculus females which had been previously superovulated with 6-8UI of PMSG and 6-8UI of HCG 48h apart. One thousand and fifty one morulae were cultured in Modified PBS + 20% FCS, at 37°C and 95% of humidity. The others 407 were cultured in Modified Whitten's medium + 3% BSA, at 37 °C, 95% of humidity and 5% of C02. At the evaluation, performed after 24h of culture, were considered developed the embryos that reached early blastocyst, expanded blastocyst, hatching blastocyst and hatched blastocyts stages. After 48h of culture were considered developed the embryos that reached at least the expanded blastocyst stage. The results obtained after 24h (87.9 and 89.4%) and 48h of culture (95.2 and 93.8%) in PBS and Whitten, respectively, were similar (p < 0,05).
Key Words: culture media, mouse, morulae, phosphate buffer, bicarbonate buffer.
INTRODUÇÃO
A composição química do fluido uterino e tubárico nos três primeiros dias após a ovulação, comparada com a existente em outros períodos da gestação e conseqüentemente com outros perfis hormonais (HAMNER, 1971) demonstra diferentes exigências nutritivas dos embriões, nos estágios iniciais de desenvolvimento. Através do cultivo de embriões em meios quimicamente definidos tem sido possível estudar os requerimentos nutritivos e o metabolismo embrionário in vitro, nos diversos estágios antes da implantação (BIGGERS, 1971; WALES, 1975).
O piruvato parece ser a melhor fonte energética para os estágios iniciais de desenvolvimento (BRINSTER, 1968), embora apenas uma restrita variação em sua concentração possa ser tolerada pêlos embriões. A partir do estágio de 8 células ocorre um aumento do consumo de oxigênio (MILLS & BRINSTER, 1967) e um aumento na habilidade de utilização de glicose e várias outras fontes de energia (BRINSTER, 1967ab/1969; WHITTINGHAM, 1971). Estas observações indicam mudanças fundamentais no metabolismo à medida que se processa o desenvolvimento embrionário, parecendo existir exigências menos específicas nos estágios mais avançados de desenvolvimento.
O sistema tampão, como parte essencial de um meio de cultivo, tem sido largamente investigado. Thomson apud BRINSTER (1968) verificou que a substituição do tampão bicarbonato por Tris ou Fosfato determina apenas a ocorrência de 1 a 3 clivagens. A importância do bicarbonato foi confirmada pelos trabalhos de WHITTINGHAM (1971), nos quais não houve desenvolvimento além da primeira ou segunda clivagem, na ausência deste íon. Além de outras possíveis funções, a presença de bicarbonato no meio de cultivo é importante para a manutenção do pH. Quando se utiliza o íon bicarbonato como tampão, especial atenção deve ser dada à concentração do mesmo e à composição da atmosfera de cultivo, pois ambos podem interferir no pH.
QUINN & WALES (1973) verificaram que o cultivo por 24 horas com tampão fosfato resulta em reduzida incorporação de carbono a partir de piruvato e lactato, em todos os estágios de desenvolvimento embrionário. A utilização do tampão fosfato diminuiu a incorporação de carbono na síntese de proteínas, RNA e DNA. Esta reduzida atividade de síntese pode resultar em menor utilização de ATP, o que pode explicar os altos níveis de ATP encontrados em embriões cultivados em meio contendo fosfato. Conforme os mesmos autores, a síntese macromolecular não é afetada pelo cultivo de embriões no estágio de mórula, em meio contendo fosfato. Neste caso, os níveis de ATP são similares aos de embriões cultivados em meio contendo bicarbonato.
Em trabalho anterior (BERNARDI et al, 1988), foi verificado que mórulas de camundongos apresentaram bons índices de desenvolvimento, quando cultivadas em PBS sem a utilização de atmosfera controlada. Devido ao fato de que, em geral, meios e condições de cultivo mais sofisticados são utilizados para o cultivo de embriões de camundongos, foi efetuada a comparação do cultivo de mórulas em PBS sem atmosfera controlada e cultivo em Whitten com 5% de C02. Embriões frescos foram utilizados visando principalmente estabelecer possíveis condições de cultivo para a avaliação de mórulas após o descongelamento.
MATERIAL E MÉTODOS
Foram utilizadas fêmeas da cepa CF1 Suíço Albina, com idade variável de 7 a 10 semanas, cuja superovulação foi efetuada através da inoculação de 6-8UI de eCGa e 6-8UI de HCGb num intervalo de 48 horas. As fêmeas foram acasaladas imediatamente após a aplicação de HCG. O sacrifício das mesmas foi efetuado através de deslocamento cervical, 76-78h após a administração de HCG. A coleta dos embriões foi realizada com meio de PBS Modificado (ELSDEN & SEIDEL, 1982) acrescido de 20% de Soro Fetal Bovino SFBc. Foram utilizadas 1458 mórulas com classificação II (boas) e III (regular), excedentes dos experimentos de congelamento efetuados a partir destas mesmas coletas.
O cultivo foi processado em placas de poliestirenod contendo mais ou menos 3ml de meio. Mil e cinqüenta e uma (1051) mórulas foram cultivadas no meio de PBS Modificado + 20% de SFB, a 37°C e 95% de umidade, enquanto 407 mórulas foram cultivadas no meio de Whitten + 3% de BSAe (WHITTEN, 1971), a 37°C, 95% de umidade e 5% de C02. A primeira avaliação foi efetuada após 24h de cultivo. Considerou-se os embriões que atingiram o estágio de blastocisto inicial (Bi), blastocisto (Bl), blastocisto expandido (Bx), blastocisto em eclosão (Bh) e blastocisto eclodido (Be). Na segunda avaliação, efetuada após 48h de cultivo, foram considerados os que atingiram no mínimo o estágio de Bx.
Os resultados obtidos foram analisados e comparados através do teste Qui-quadrado.
RESULTADOS
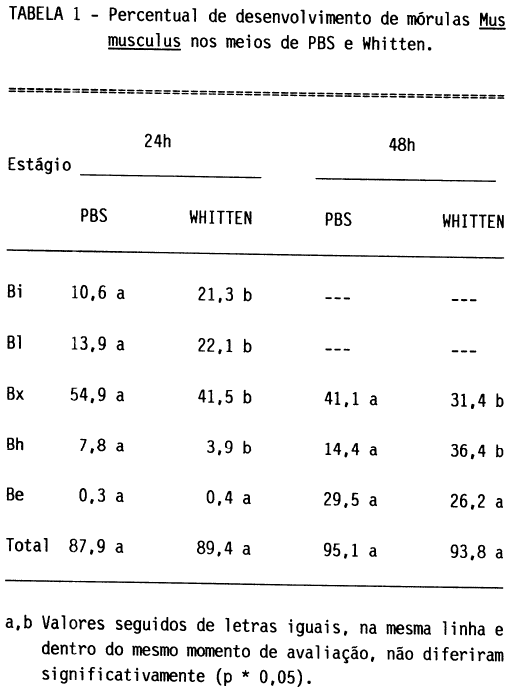
Os percentuais de desenvolvimento obtidos após 24 e 48h são apresentados na tabela 1. O percentual total de desenvolvimento após 24h foi de 87,9 e 89,4 e, após 48h, de 95,1 e 93,8, para os embriões cultivados em PBS e Whitten, respectivamente. Estes índices foram estatisticamente semelhantes (p < 0,05).
Um maior número de blastocistos expandidos e blastocistos em eclosão foi verificado com cultivo em PBS, após 24h (p < 0,05). Um maior percentual de blastocistos em eclosão ocorreu após 48h de cultivo em Whitten (p < 0,05). Os índices de embriões que eclodiram foram semelhantes (p < 0,05) para ambos os meios e nas duas avaliações efetuadas.
DISCUSSÃO
Neste experimento, não foi testada a viabilidade in vivo dos embriões cultivados, embora TROUNSON et al (1976) tenham verificado que o cultivo em PBS durante 48h não interferiu na viabilidade de embriões bovinos, após a transferência dos mesmos. Além da transferência para fêmeas pseudoprenhes, a viabilidade após cultivo poderia ter sido avaliada e comparada através da utilização de acetato de fluoresceína (LEIBO & MAZUR, 1978; BIELANSKI et al, 1986) ou pela contagem do número de células (LINARES & KING, 1980), o que talvez fornecesse uma idéia mais exata da capacidade de implantação e desenvolvimento destes embriões. Apesar desta consideração, o cultivo em PBS sem a suplementação de C02 já foi utilizado por outros autores, após o descongelamento de embriões de camundongos (WILLIAMS & JOHNSON, 1985/1986) e ratos (CHUPIN & REVIERS, 1986), com a obtenção de elevados índices de sobrevivência.
Apesar do índice final de desenvolvimento não ter diferido entre os dois sistemas, um maior número de embriões em estágios mais avançados, após 24h, e um menor número de blastocistos em eclosão, após 48h, com a utilização de PBS, confirma o fato do tampão fosfato ser mais adequado para manipulações ou cultivos de curta duração, sendo este capaz de manter um certo grau de estabilidade do pH mesmo em atmosfera não controlada. Uma menor habilidade em permitir a eclosão in vitro também foi observada quando mórulas e blastocistos iniciais de bovinos foram cultivados em PBS, com suplementação (RAJAMAHENDRAN et al, 1985) ou sem suplementação de C02 (SMITH et al, 1985), em comparação ao cultivo em HAM F-10.
Em termos de síntese de macromoléculas, foi observado por QUINN & WALES (1973) que mórulas de camundongos cultivadas em meio fosfatado apresentaram igual desenvolvimento e padrão metabólico ao apresentado por mórulas cultivadas em meio bicarbonatado. Em bovinos, a concentração de C02 também parece não ser crítica para o desenvolvimento a partir do estágio de mórula, visto que as necessidades, tanto de C02 como de HC03, podem ser supridas a partir do soro utilizado na suplementação do meio de cultivo (KANE, 1987).
CONCLUSÕES
Pelo fato do número total de embriões desenvolvidos, desconsiderando o estágio de desenvolvimento atingido, ter sido semelhante com a utilização de PBS e Whitten nas 24 como 48h de cultivo, é possível utilizar o cultivo em PBS sem controle da concentração de C02, principalmente quando o objetivo é verificar o percentual de desenvolvimento in vitro. Esta particularidade permite a realização de avaliações do índice de sobrevivência, mesmo em laboratórios menos equipados.
FONTES DE AQUISIÇÃO
a - INTERGONAN - Vemie Veterinar Chemie, 4152 Kempen, 1 - RFA.
b - PRIMOGONYL - Shering AG - Pharma D-1000 Berlin, 65 - RFA.
c - LABORCLIN - Cassiano Ricardo, 455 - Pinhais - Piraquara - PR.
d - DESCARPLAST - Estrada dos Menezes, 225 - São Gonçalo - RJ
e - SERVA - D-6900 HeideIberg-RFA.
2Médicos Veterinários, Pós-Graduandos em Reprodução Animal - Universidade Federal de Santa Maria - UFSM - Bloco 53, apt° 24, Campus UFSM. 97.119 - Santa Maria, RS.
3Médico Veterinário, Doutora. Prof. Adjunto Dept° Clínica Grandes Animais - UFSM. 97.119 - Santa Maria, RS.
4Acadêmicos do Curso de Medicina Veterinária - UFSM. 97.119 - Santa Maria, RS.
Aprovado para publicação em 06.11.91.
- BERNARDI, M.L., RUBIN, M.I.B., METZDORF, A. Desenvolvimento in vitro de embriões Mus musculus em PBS Modificado como parâmetro de avaliação da viabilidade pós-descongelamento. Rev. Centro Ciências Rurais, v. 18, p. 61, 1988. Suplemento.
- BIELANSKI, A., SCHNEIDER, U., PAWLYSHYN, V.P., et al. Factors affecting survival of deep frozen bovine embryos in vitro: the effect of freezing container and method o f removing cryoprotectant. Theriogenology, v. 25, n. 3, p. 429-437, 1986.
- BIGGERS, J. D. Metabolismo of mouse embryos. J Reprod Fert, v. 14, p. 41-54, 1971. Suppl.
- BRINSTER, R. L. Carbon dioxide production from glucose by the preimplantation mouse embryo. Exp Cell Res, v. 47, p. 271-277, 1967a.
- BRINSTER, R. L. Carbon dioxide production from lactate and pyruvate by the preimplantation mouse embryo. Exp Cell Res, v. 47, p. 634-637, 1967b.
- BRINSTER, R.L. Mammalian embryo culture. In: HAFEZ, E.S.E., BLANDAU, R. J. The Mammalian Oviduct Chicago: University of Chicago, 1968. Cap. 18, p. 419-444.
- BRINSTER, R.L. Incorporation of carbon from glucose and pyruvate into the preimplantation mouse embryo. Exp Cell Res, v. 58, p. 153-158, 1969.
- CHUPIN, D., DE REVIERS, M.M. Quick freezing of rat embryos. Theriogenology, v. 26, n. 2, p. 157-165, 1986.
- ELSDEN, R.P., SEIDEL Jr., G.E. Embryo Transfer Procedures for Cattle Colorado: Colorado State University, 1982. 41 p.
- HAMNER, O.E. Composition of oviductal and uterine fluids. Adv Biosc, v. 6, p. 143-164, 1971.
- KANE, M. Culture media and culture of early embryos. Theriogenology, v. 27, n. 1, p. 49-57, 1987.
- LEIBO, S.P., MAZUR, P. Methods for preservation of mammalian embryos by freezing. In: DANIEL Jr., J.C. Methods in Mammalian Reproduction, New York: Academic Press, 1978. p. 179-201.
- LINARES, T., KING, W.A. Morphological study of the bovine blastocyst with phase contrast microscopy. Theriogenology, v. 14, n. 2, p. 123-133, 1980.
- QUINN, B.S., WALES, R.G. Growth and metabolism of preimplantation mouse embryos cultured in phosphate-buffered medium. J Reprod Fert, v. 35, p. 289-300, 1973.
- MILLS Jr., R.M., BRINSTER, R.L. Oxigen consumption of preimplantation mouse embryos. Exp Cell Res, v. 47, p. 337-344, 1967.
- RAJAMAHENDRAN, R., CANSECO, R.S., GWAZDAUSKAS, F.C., et al. Observations of in vitro development of bovine morulae in Ham's F-10 and Dulbecco's phosphate buffered saline supplemented with normal steer serum. Theriogenology, v. 24, n. 3, p. 369-374, 1985.
- SMITH, B.J., SPIRE, M.F., DAVIS, D.L., et al. Bovine embryo development in Dulbecco's phosphate buffered saline and Ham's F-10 medium with Hepes buffer. Theriogenology, v. 25, n. 1, p. 199, 1986. Abstract.
- TROUNSON, A.O., WILLADSEN, S.M., ROWSON, L.E.A. The influence of in vitro culture and cooling on the survival and development of cow embryos. J Reprod Fert, v. 47, p. 367-374, 1976.
- WALES, R. G. Maturation of the mammalian embryo: biochemical aspects. Biol Reprod, v. 12, p. 66-81, 1975.
- WHITTEN, W. K. Nutrient requirements for the culture of preimplantation embryos in vitro Adv Biosc, v. 6, p. 129-138, 1971.
- WHITTINGHAM, D.G. Culture of mouse ova. J Reprod Fert, v. 14, p. 7-21, 1971.
- WILLIAMS, T.J., JOHNSON, S.E. Quick-freezing of day four mouse embryos. Theriogenology, v. 23, n. 1, p. 235, 1985. Abstract.
- WILLIAMS, T.J., JOHNSON, S.E. A method for one-step freezing of mouse embryos. Theriogenology, v. 26, n. 1, p. 125-133, 1986.
Datas de Publicação
-
Publicação nesta coleção
25 Set 2014 -
Data do Fascículo
Ago 1991
Histórico
-
Aceito
06 Nov 1991