Resumos
OBJETIVO: A pesquisa foi conduzida de maneira a se esclarecer, através de uma meta-análise, as evidências da suplementação de antioxidantes como terapia adjuvante na prevenção dos danos oxidativos e melhora do desfecho clínico, tais como mortalidade, tempo de hospitalização e ventilação mecânica. MÉTODOS: A estratégia de busca de ensaios clínicos randomizados (ECRs) envolveu a participação de dois pesquisadores que avaliaram, de forma independente, a qualidade metodológica de cada artigo, disponível full text, nas bases de dados PubMed, ISI of Knowledge e ScienceDirect. RESULTADOS: Foram extraídos 110 estudos dos últimos 10 anos, porém somente 30 artigos preencheram os critérios metodológicos (ensaios controlados, randomizados, cego e estatisticamente significativo), totalizando 241 animais e 256 pacientes. Este trabalho encontrou um OR de 0,45 [intervalo de confiança (IC) 95%: 0,26 - 0,79] para a mortalidade na comparação do grupo experimental com placebo (6 estudos, n = 256), um OR de de 0,46 [intervalo de confiança (IC) 95%: 0,26 - 0,87] para tempo de hospitalização e um OR de 0,63 [intervalo de confiança (IC) 95%: 0,35 - 1,12] para o tempo de ventilação mecânica assistida entre os grupos. CONCLUSÃO: As evidências são conflitantes e, desta forma, ainda não é possível recomendar o uso rotineiro da suplementação com antioxidantes em pacientes criticamente enfermos.
Antioxidantes; Lesão pulmonar aguda; Radicais livres
OBJECTIVE: This meta-analysis was performed to evaluate the evidence supporting antioxidant supplementation as an adjunct therapy to prevent oxidative damage and improve the clinical outcomes (mortality, length of hospital stay and duration of mechanical ventilation). METHODS: The search strategy for randomized controlled trials (RCTs) involved the participation of two researchers who independently assessed the methodological quality of each full-text article that was available in the PubMed, ISI WEB of Knowledge and ScienceDirect databases. RESULTS: We extracted 110 studies from the past 10 years, but only 30 articles met the methodological criteria (RCT, blinded and statistically significant results), for a total of 241 animals and 256 patients. This study found an odds ratio (OR) of 0.45 [95% confidence interval (CI): 0.26 to 0.79] for death in the experimental group compared with placebo (six trials, n = 256), an OR of 0.46 [95% CI: 0.26 to 0.87] for hospitalization time and an OR of 0.63 [95% CI: 0.35 to 1.12] for mechanical ventilation time between groups. CONCLUSION: Conflicting evidence makes it impossible to recommend the routine use of antioxidant supplementation in critically ill patients.
Antioxidants; Acute lung injury; Free radicals
ARTIGO ORIGINAL
Suplementação de antioxidantes no tratamento da lesão pulmonar aguda: meta-análise
André Martins GalvãoI; Armele Dornelas de AndradeII; Maria Bernadete de Souza MaiaIII; Keyla Emanuelle Ramos da SilvaIV; Alice de Andrade BezerraV; Juliana Felix de MeloVI; Natalia Gomes de MoraisVII; Thacianna Barreto da CostaVII; Célia Maria Machado Barbosa de CastroVIII
IPrograma de Pós-graduação (Doutorado) do Laboratório de Imunopatologia Keizo Asami - LIKA da Universidade Federal de Pernambuco UFPE - Recife (PE), Brasil
IILaboratório de Fisioterapia Cardiopulmonar da Universidade Federal de Pernambuco UFPE - Recife (PE), Brasil
IIILaboratório de Farmacologia de Produtos Bioativos da Universidade Federal de Pernambuco UFPE - Recife (PE), Brasil
IVPrograma de Pós-graduação (Doutorado) do Laboratório de Tecnologia dos Medicamentos da Universidade Federal de Pernambuco UFPE - Recife (PE), Brasil
VPrograma de Pós-graduação (Mestrado) em Ciências Biológicas da Universidade Federal de Pernambuco UFPE Recife (PE), Brasil
VIPrograma de Pós-graduação (Doutorado) em Medicina Tropical da Universidade Federal de Pernambuco UFPE - Recife (PE), Brasil
VIIPrograma de Pós-graduação (Mestrado) em Medicina Tropical da Universidade Federal de Pernambuco UFPE - Recife (PE), Brasil
VIIILaboratório de Microbiologia e Cultura de Células do Laboratório de Imunopatologia Keizo Asami - LIKA da Universidade Federal de Pernambuco UFPE - Recife (PE), Brasil
Autor correspondente Autor correspondente: André Martins Galvão Laboratório de Imunopatologia Keizo Asami - LIKA/UFPE Avenida dos Reitores, S/N - Cidade Universitária CEP: 50670-901 Recife (PE), Brasil Fone: + 55 (81) 2126-8484 Fax: + 55 (81) 2126-8484 E-mail: andremgalvao@hotmail.com
RESUMO
OBJETIVO: A pesquisa foi conduzida de maneira a se esclarecer, através de uma meta-análise, as evidências da suplementação de antioxidantes como terapia adjuvante na prevenção dos danos oxidativos e melhora do desfecho clínico, tais como mortalidade, tempo de hospitalização e ventilação mecânica.
MÉTODOS: A estratégia de busca de ensaios clínicos randomizados (ECRs) envolveu a participação de dois pesquisadores que avaliaram, de forma independente, a qualidade metodológica de cada artigo, disponível full text, nas bases de dados PubMed, ISI of Knowledge e ScienceDirect.
RESULTADOS: Foram extraídos 110 estudos dos últimos 10 anos, porém somente 30 artigos preencheram os critérios metodológicos (ensaios controlados, randomizados, cego e estatisticamente significativo), totalizando 241 animais e 256 pacientes. Este trabalho encontrou um OR de 0,45 [intervalo de confiança (IC) 95%: 0,26 - 0,79] para a mortalidade na comparação do grupo experimental com placebo (6 estudos, n = 256), um OR de de 0,46 [intervalo de confiança (IC) 95%: 0,26 0,87] para tempo de hospitalização e um OR de 0,63 [intervalo de confiança (IC) 95%: 0,35 - 1,12] para o tempo de ventilação mecânica assistida entre os grupos.
CONCLUSÃO: As evidências são conflitantes e, desta forma, ainda não é possível recomendar o uso rotineiro da suplementação com antioxidantes em pacientes criticamente enfermos.
Descritores: Antioxidantes/uso terapêutico; Lesão pulmonar aguda/ quimioterapia; Radicais livres
INTRODUÇÃO
A suplementação com antioxidantes(1-3) pode prolongar a fase de iniciação ou inibir a fase de propagação das espécies reativas de oxigênio (ROS) e nitrogênio (RON). (4) A ruptura do equilíbrio oxidante-antioxidante tem um papel importante na patogênese de doenças inflamatórias, como a lesão pulmonar aguda (LPA) ou síndrome do desconforto respiratório agudo (SDRA).(5,6) Tradicionalmente, os antioxidantes têm sido administrados por via oral,(3) intraperitoneal(1) e intravenosa.(2) Pacientes com SDRA, apresentam uma diminuição significativa, quando comparados a indivíduos saudáveis, nas concentrações de glutationa (138 ± 25 vs 7 ± 4 μM) e ácido ascórbico (85 ± 21 vs 27 ± 10 μM), no lavado broncoalveolar (LBA), nos níveis plasmáticos de α-tocoferol (11.46 ± 0.55 vs. 7.73 ± 0.54 mg/L), β-caroteno e selênio.(7,8) As concentrações plasmáticas de peróxidos lipídicos também são significativamente mais elevadas em relação ao controle (malonaldeído - MDA, 2.2 vs 1.3 nMol).(9,10)
Além disso, os pacientes com a doença ou em risco para SDRA exibem uma diminuição significativa na concentração de ácidos graxos poliinsaturados a nível plasmático (ácido linoléico, 26.9 ± 4.6 vs 18.5 ± 4.8 nMol; ácido araquidônico, 11.7 ± 1.68 vs 8.33 ± 2.46 nMol; ácido eicosapentanóico, 0.25 ± 0.14 vs 0.017 ± 0.004 nMol), sugerindo que a SDRA apresenta uma relação direta com a deficiência de ácidos graxos essenciais.(10) Os indivíduos com SDRA também apresentam uma diminuição significativa dos níveis de óxido nítrico, no plasma (NO, 1.7 vs 0.7 μMol).(9,11) Em contrapartida, as ações do NO podem ter efeitos benéficos ou prejudiciais,(12) pois este pode atuar como uma espécie de proteção ou um pró-oxidante precursor de peroxinitrito.
Participação dos neutrófilos e macrófagos
O acúmulo de neutrófilos e macrófagos (polimorfonucleares, no plasma, 5x106 vs 4x106 cel/mL; Macrófagos, no LBA, 12x106 vs 1x106 cel/mL) desempenha um papel significativo no desenvolvimento de lesão pulmonar aguda em relação ao grupo controle (atividade da mieloperoxidase, MPO, 15 vs 5 nmol/min/pulmão, p<0.05; atividade da elastase de neutrófilos, 10 vs 2.5 x10 nmols/mL, p<0.05; concentração de proteínas totais, no LBA, 7 vs 3 mg/mL, p<0.05),(13,14) mas, como a SDRA pode ocorrer em pacientes neutropênicos, é possível que exista a influência de outros marcadores inflamatórios, incluindo outros tipos de células, e a participação de fatores não bioquímicos.(15) O papel fisiológico dos neutrófilos na defesa do hospedeiro é feito não só pela produção e liberação de ROS, mas também pela liberação de proteases (como por exemplo, elastase). A efetiva neutralização dos radicais livres e das proteases por antioxidantes (vitamina C, 80 μmol/l plasma) e antiproteases (α1-antitripsina, 54 μmol/l plasma, e α2-macroglobulina, 3 μmol/l plasma),(13) impede que a lesão pulmonar se agrave.(16) Existem indícios(17) de que a formação do edema pulmonar, comumente encontrado nos pacientes com SDRA, seja resultante da produção exagerada de peróxido de hidrogênio, H2O2, radical hidroxila, *OH, e ânion su peróxido, *O2 (após 5 minutos de lesão pulmonar, [*O2-] 4 vs 9 nMol/min), liberados pelos neutrófilos.(13) O desequilíbrio entre protease-antiprotease e oxidante-antioxidante pode desempenhar um papel importante na patogênese da SDRA.(18)
MÉTODOS
Inicialmente, a estratégia de busca envolveu a participação de dois pesquisadores que avaliaram, de forma independente, a qualidade metodológica de cada artigo, disponível full text nas bases do Pubmed, ScienceDirect e ISI Web of knowledge. O uso da suplementação de antioxidantes em pacientes com lesão pulmonar aguda ou síndrome do desconforto respiratório agudo foi definido como foco da investigação. Posteriormente, foram feitas buscas de estudos clínicos aleatorizados randomizados (ECRs) e cego. Além disso, os autores buscaram padronizar a avaliação da qualidade metodológica dos estudos por meio da aplicação da escala PEDro como critério de validação interna. Os desfechos objetivados na busca, julgados como clinicamente relevantes, foram os seguintes:
- Dano oxidativo (peroxidação lipídica, carbonilação protéica ou oxidação do DNA);
- Resposta inflamatória e imune;
- Injúria tecidual; Mortalidade;
- Tempo de internação hospitalar;
- Tempo de ventilação mecânica assistida.
Na estratégia de busca, a fim de evitar perda de estudos que eventualmente tivessem a descrição de tais desfechos somente no artigo completo, sem relato no resumo, não foram colocadas palavras referentes aos desfechos de interesse. A estratégia de busca utilizada foi a seguinte: para o Pubmed os Limites ativados foram: Clinical Trial OR Randomized Controlled Trial OR Clinical Tria AND Phase I OR Clinical Trial AND Phase II OR Clinical Trial AND Phase III OR Clinical Trial AND Phase IV OR Controlled Clinical Trial AND published in the last 10 years. Para o ScienceDirect e o ISI Web of knowledge os limites ativados foram: Journals AND all sources AND all sciences AND published in the last 10 years. No boleamento das palavras-chaves (MESH) foram feitas as possíveis combinações: [supplementation AND acute lung injury OR acute respiratory distress syndrome OR oxidative damage OR outcome OR injury OR antioxidants].
Após a realização da busca, cuja data limite foi 17/06/2010, foram avaliados todos os resumos encontrados. Estudos descritos com delineamento de ensaio clínico e que compararam o uso de antioxidantes contra placebo ou outra droga ativa foram selecionados para busca do texto completo. Não foram procurados abstracts que pudessem levar a estudos não publicados nas bases de periódicos ou em andamento ou aqueles estudos os quais estavam disponíveis apenas em bancos de dissertações ou Teses. Os estudos incluídos tiveram suas referências revisadas para busca de outros possíveis estudos relevantes. O método escolhido para realizar a compilação da evidência disponível foi o de metanálise. Optou-se por um critério de inclusão pragmático, onde todos os ensaios clínicos randomizados controlados (ECRs) com os desfechos pré-especificados foram incluídos, sendo os critérios de qualidade metodológica utilizados em posteriores análises da escala PEdro. Quando o escore da escala PEDro era menor que três o estudo era excluído por insuficiência metodológica. De acordo com recomendações atuais, os seguintes critérios metodológicos foram julgados como os mais relevantes:
- Descrição de cálculo de tamanho de amostra;
- Descrição do sigilo da lista de alocação;
- Utilização de cegamento.
A ausência de descrição explícita de uma lista de alocação sigilosa - que poderia englobar termos como randomização central, randomização via Internet, randomização por central telefônica, ou uma afirmação clara confirmando sigilo da lista de alocação - igualmente levava a julgamento de não preenchimento desse critério. Já no tocante ao cegamento, tanto os estudos descritos como abertos (open label) como os estudos sem nenhuma descrição sobre cegamento foram considerados como não cegos. Pela sua maior facilidade de interpretação, a medida de associação escolhida foi o risco relativo (RR). Já o método de cálculo utilizado foi o de efeitos fixos de Mantel-Haenszel. Para avaliar a heterogeneidade entre os estudos, foi utilizado o teste de inconsistência (I2), sendo valores inferiores a 25% considerados como pequena heterogeneidade. Nessas análises, os cálculos de metanálise foram refeitos excluindo-se os estudos que não preenchessem determinado critério de qualidade. Além disso, os cálculos dos resultados principais (ou seja, com todos os estudos incluídos) foram refeitos utilizando-se o método de efeitos fixos, além de uso de cálculo por razão de chances (odds ratio - OR) ao invés de RR. Análise de funil (funnel plot) foi empregada para avaliar o impacto de viés de publicação. As análises foram conduzidas no programa R, versão 2.12.1.
RESULTADOS
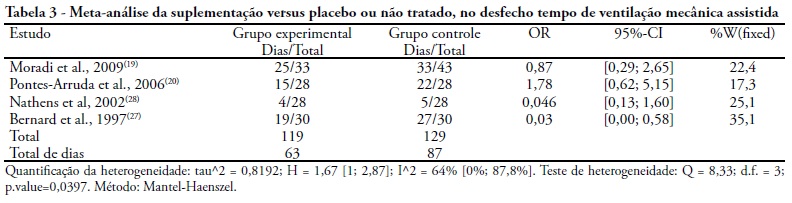
A estratégia de busca encontrou 9 estudos no PubMed, 11 no ISI Web of Knowledge e 90 no ScienceDirect, totalizando 110 estudos potencialmente relevantes. Os 81 estudos eliminados nessa etapa estão pormenorizados na figura 1. Este trabalho encontrou um OR de 0,45 [intervalo de confiança (IC) 95%: 0,26 - 0,79] para morte na comparação do grupo experimental com placebo (6 estudos, n = 256), um OR de 0,46 [intervalo de confiança (IC) 95%: 0,26 0,87] para tempo de hospitalização e um OR de 0,63 [intervalo de confiança (IC) 95%: 0,35 - 1,12] para o tempo de ventilação mecânica assistida entre os grupos (Tabelas 1, 2 e 3). Os desfechos objetivados em nosso trabalho, como injúria tecidual ou falência de órgãos, não foram possíveis de ser contemplados nessa revisão. A estratégia de busca utilizada gerou um total de 110 resultados, dentre os quais, 16 review, 7 serial review, 3 letter/editorial, 2 fórum, 2 regular article, 1 research letter, 40 estudos clínicos controlados randomizados (ECRs, 33 pré-clinicos e 17 clínicos). Dos 40 ECRs disponíveis para análise, somente 29 tinham os desfechos de interesse.
Os desfechos mais comuns dos ECRs que não incluíram análises foram parâmetros hemodinâmicos, histopatológicos e alteração da cinética de marcadores.
O desfecho primário mais comum dos estudos incluí dos foi o dano oxidativo (peroxidação lipídica, carbonilação protéica e alteração do balanço de grupos tióis e enzimas antioxidativas), sendo relatado em 24 dos 40 estudos de forma individual. Como desfecho secundário segue a taxa de mortalidade associada ao tempo de permanência hospitalar e de ventilação mecânica assistida. O tempo de seguimento para a suplementação variou entre 6h e 28 dias (Quadro 1). No estudo de Moradi(19) houve redução da taxa de mortalidade e no tempo de hospitalização, sem diferença estatisticamente significativa. Porém, quanto à redução do tempo de ventilação mecânica assistida, nesse mesmo estudo houve diferença estatística significativa. Dos 6 estudos clínicos disponíveis para a avaliação sobre a associação da suplementação com a taxa de mortalidade, tempo de hospitalização e de ventilação mecânica assistida, apenas 4 realizaram comparação com grupo placebo ou não tratado (Figuras 2, 3 e 4). Um estudo realizou análise da resposta imune mediada pelas citocinas, IL-1, IL-6, IL-8 e TNF-α, associadas ao dano alveolar (sem diferença estatisticamente significativa). Enquanto que apenas o estudo de Pontes-Arruda(20) evidenciou que os principais efeitos adversos associados aos antioxidantes foram os eventos gastrointestinais, tais como a diarréia e dispepsia, porém sem diferença estatisticamente significativa.
DISCUSSÃO
Ensaios pré-clínicos
Uma estratégia para limitar o dano pulmonar oxidativo é aumentar o acúmulo intracelular de glutationa (GSH) utilizando seus precursores, como a N-acetilcisteína (NAC).(13) A glutationa (GSH) apresenta uma função protetora vital, intra e extra-celularmente, contra o estresse oxidativo nos pulmões.(15) A síntese da enzima GSH é dependente da glutamilcisteína-ligase (GCL). A inibição da GCL inibe a GSH e, consequentemente, induz a morte celular por apoptose. A região promotora (5'-flanking) da GCL é regulada pela proteína ativadora-1 (AP-1) e sofre modulação de agentes oxidantes, antioxidantes fenólicos e fatores de crescimento em várias células. Alterações no metabolismo da glutationa (GSH), nos alvéolos e no tecido pulmonar, são amplamente reconhecidas como característica central de muitas doenças pulmonares.(21,22)
A NAC pode estimular a síntese de GSH, aumentar a atividade da glutationa-S-transferase (GST) e atuar diretamente sobre radicais livres. A administração de NAC reduz significativamente a atividade da MPO, os níveis de malondialdeído (MDA) e de 3-nitrotirosina (3-NT) no tecido pulmonar.(23) O aumento da absorção e da concentração intracelular de NAC pode ser realizado pelo uso de lipossomas (L-NAC). O pré-tratamento com L-NAC (NAC, 25mg/kg intravenoso, iv) resulta em aumentos significativos nos níveis de proteína não-tióis e nos níveis de NAC em homogeneizados de pulmão (p<0,05) e no lavado broncoalveolar (p<0,001). A formulação lipossomal (L-NAC) é mais eficaz do que a NAC, formulada convencionalmente, em atenuar as lesões pulmonares induzidas por endotoxina de E.coli (lipolissacarídeo, LPS). A suplementação com NAC, em animais expostos ao LPS, resulta em diminuição do edema pulmonar, da peroxidação lipídica, do dano à enzima conversora de angiotensina (ECA), das concentrações de cloraminas e dos eicosanóides tromboxano e leucotrienos (LTB2 e LTB4) no pulmão.(24,25)
A hiperóxia e as infecções pulmonares são bem conhecidas por aumentarem o risco de lesão pulmonar aguda e crônica, mas não está claro se a hiperóxia aumenta diretamente o risco de pneumonia. Arita et al.(26) realizaram um estudo no qual se relacionou o efeito dos antioxidantes sobre a função antimicrobiana de macrófagos expostos a hiperóxia. Os macrófagos de camundongos foram expostos ao ar ambiente ou a frações de 95% de oxigênio durante 24 horas e, em seguida, incubados com Pseudomonas aeruginosa e após 1 h foram analisadas a adesão bacteriana, fagocitose e a produção de proteínas inflamatórias de macrófagos (MIP)-1α. A aderência bacteriana aumentou 5,8 vezes (p <0,0001), a fagocitose diminuiu em 60% (p <0,05), e a produção de MIP-1α aumentou 49% (p <0,05) em resposta à hiperóxia. Em presença de enzimas antioxidantes como a magnésio superoxido dismutase (MnSOD) ou catalase há diminuição significativa da adesão bacteriana em 30,5%, mas apenas a MnSOD melhorou significativamente a fagocitose bacteriana e atenuou a produção de MIP-1α. Os dados indicam que a MnSOD reduz a aderência de bactérias e a inflamação, além de melhorar a fagocitose bacteriana em células mononucleares em resposta à hiperóxia. Este mecanismo de ação minimiza o desenvolvimento de lesão pulmonar induzida por oxidantes, bem como reduz as infecções nosocomiais.(26)
Ensaios clínicos
A suplementação de 150 mg/kg de N-acetilcisteína (NAC), in bolus, seguido de 50 mg/kg/dia de NAC, por 4 dias, em 27 pacientes com LPA ou síndrome do desconforto respiratório agudo, SDRA, melhorou a taxa de oxigenação do primeiro ao quarto dia (PaO2/FiO2, 440.9 ± 47.5 vs 151.2 ± 24.6, p< 0.001), diminuiu a mortalidade (35.7% vs 76.9%, p= 0.031), porém não afetou a duração da ventilação mecânica (24.8 ± 8.5 vs 32.9 ± 9.8, p= 0.539).(19) Estes resultados evidenciam que a suplementação com NAC, intravenoso, tem um efeito benéfico sobre a relação perfusão-ventilação e traz um impacto favorável sobre a taxa de sobrevivência. Dietas enterais enriquecidas com ácido eicosapentaenóico (4.5 g/L), ácido gama-linoléico (4.3 g/L) e antioxidantes (320 IU/L de vitamina E, 840 mg/L de vitamina C e 320 mg/L de taurina) apresentaram um risco relativo de morte de 0.63 (IC 95%, 0.39-1.00). Este tipo de dieta também reduziu o número de dias de ventilação mecânica (13.4 ± 1.2 vs 5.8 ± 1.0, p < 0.001) e de UTI (10.8 ± 1.1 vs. 4.6 ± 0.9, p < 0.001), além de reduzir o número de órgãos acometidos por disfunções (38 vs. 81%, respectivamente, p < 0.001). Estes resultados confirmam os benefícios que dietas enriquecidas com antioxidantes podem trazer aos pacientes com SDRA, porém são conflitantes quanto aos benefícios sobre a taxa de oxigenação (156.1 ± 2.5 vs. 158.4 ± 2.7, p valor > 0.05) e duração da ventilação mecânica.(20)
Outro benefício alcançado pela suplementação intravenosa (IV) a cada 8 h por 10 dias, de 70 mg/kg de NAC (n = 14) ou de 63 mg/kg de procisteína-OTZ (n = 17) foi a redução do número de dias de lesão pulmonar aguda (p valor < 0.05) e o aumento do índice cardíaco em ambos os grupos de tratamento com antioxidantes (NAC / OTZ [+] 14%; placebo [-] 6%, p valor < 0.05). Porém, a suplementação com NAC ou OTZ não trouxe diferença na mortalidade entre os grupos (placebo, 40%; NAC, 36%; OTZ, 35%). Esse tipo de tratamento pode encurtar a duração da lesão pulmonar aguda, porém mais estudos são necessários.(27) Apesar destas evidências, a presença de complicações (vieses), como o rebaixamento do nível de consciência e extubações de sondas de alimentação ou tubos orotraqueais pode afetar os resultados entre a suplementação com antioxidantes e a taxa de oxigenação, duração da ventilação mecânica, tempo de permanência hospitalar e taxa de mortalidade. Além disso, os estudos avaliaram populações com idade superior a 43 anos e predominantemente masculina.
Pacientes (n=81) que receberam 60 IU/L de α-tocoferol e 340 mg/L de ácido ascórbico por sonda orogástrica apresentaram um risco relativo de morbidade pulmonar (uma medida composta de SDRA e pneumonia nosocomial) de 0,81 (IC 95% de 0,60 a 1,1). A falência de múltiplos órgãos entre os pacientes que receberam suplementação com antioxidante foi significativamente menor (6,1% vs 2,7%), com um risco relativo de 0,43 (IC 95% de 0,19 a 0,96). A administração precoce de α-tocoferol e ácido ascórbico também encurtou o tempo de permanência na UTI (9 vs 3 dias) com um risco relativo de 0.32 (IC 95% de 0.09-1.2). Apesar da suplementação com ácido ascórbico e alfa-tocoferol ter reduzido a concentração de isoprostano (70.7 vs 14.8 pg/mL) a contagem de células brancas (3.7 x 105 vs 2.7 x 105/mL, p= 0.42), a concentração de Fator de Necrose Tumoral (5.6 vs 2.7 pg/mL, p= 0.27), a concentração de interleucina-1 (23.1 vs 4.7 pg/mL, p= 0.26) e a concentração de interleucina-6 (126.7 vs 49.9 pg/mL, p= 0.64), não houve diferença estatística significativa. Outro dado que chama a atenção é que a suplementação aumentou a concentração de interleucina-8 (IL-8, 239.6 vs 284.4 pg/mL, p= 0.81), mas este aumento não foi estatisticamente significativo.(28) Estes resultados são conflitantes com a literatura(29) uma vez que mesmo encontrando redução nas concentrações dos marcadores inflamatórios como isoprostano, IL-1, IL-6 e TNF, esses resultados mostraram que isto poderia ocorrer mesmo sem a suplementação de antioxidantes.
CONSIDERAÇÕES FINAIS
Os resultados dos estudos, em modelos animais, mostram que a suplementação com antioxidantes está associada com melhores índices de oxigenação, atividade das enzimas MPO, ECA, GSH, MnSOD e Catalase, resposta imunológica (diminuição de Isoprostanos, LTB2, LTB4, IL-1, IL-4 e IL-6) e atividade antibacteriana (aumento da taxa de adesão dos monócitos e de fagocitose dos macrófagos). Além disso, houve redução dos níveis de ROS (radical hidroxil e peróxido de hidrogênio) e RON (nitritos e nitratos), diminuição da peroxidação lipídica (TBARS e MDA) no plasma e lavado broncoalveolar. Nos pacientes com LPA/SDRA houve redução do tempo de hospitalização, duração da ventilação mecânica, permanência na UTI, disfunção de múltiplos órgãos e taxa de mortalidade. Porém, as evidências são conflitantes e, desta forma, ainda não é possível recomendar o uso rotineiro da suplementação com antioxidantes em pacientes criticamente enfermos. O primeiro passo a ser realizado seria determinar a dose e a via de administração mais segura e, posteriormente, realizar ensaios multicêntricos, rigorosamente desenhados e randomizados, para elucidar a eficácia isolada ou combinada dos antioxidantes durante a LPA/SDRA.
Submetido em 5 de Novembro de 2010
Aceito em 1º de Março de 2011
Conflitos de interesse: Nenhum.
Trabalho desenvolvido no setor de Microbiologia Clínica e Cultura de Células do Laboratório de Imunopatologia Keizo Asami - LIKA da Universidade Federal de Pernambuco Recife (PE), Brasil.
Referências bibliográficas
- 1. Bhavsar TM, Cantor JO, Patel SN, Lau-Cam CA. Attenuating effect of taurine on lipopolysaccharideinduced acute lung injury in hamsters. Pharmacol Res. 2009;60(5):418-28.
- 2. Mitsopoulos P, Omri A, Alipour M, Vermeulen N, Smith MG, Suntres ZE. Effectiveness of liposomal- N-acetylcysteine against LPS-induced lung injuries in rodents. Int J Pharm. 2008;363(1-2):106-11.
- 3. Teixeira KC, Soares FS, Rocha LG, Silveira PC, Silva LA, Valenca SS, et al. Attenuation of bleomycin-induced lung injury and oxidative stress by N-acetylcysteine plus deferoxamine. Pulm Pharmacol Ther. 2008;21(2):309-16.
- 4. Quinlan GJ, Evans TW, Gutteridge JM. Iron and the redox status of the lungs. Free Radic Biol Med. 2002;33(10):1306-13.
- 5. Zhang H, Slutsky AS, Vincent JL. Oxygen free radicals in ARDS, septic shock and organ dysfunction. Intensive Care Med. 2000;26(4):474-6.
- 6. Lang JD, McArdle PJ, O'Reilly PJ, Matalon S. Oxidantantioxidant balance in acute lung injury. Chest. 2002;122(6 Suppl):314S-320S. Review.
- 7. Bowler RP, Velsor LW, Duda B, Chan ED, Abraham E, Ware LB, et al. Pulmonary edema fluid antioxidants are depressed in acute lung injury. Crit Care Med. 2003;31(9):2309-15.
- 8. Richard C, Lemonnier F, Thibault M, Couturier M, Auzepy P. Vitamin E deficiency and lipoperoxidation during adult respiratory distress syndrome. Crit Care Med. 1990;18(1):4-9.
- 9. Kumar KV, Rao SM, Gayani R, Mohan IK, Naidu MU. Oxidant stress and essential fatty acids in patients with risk and established ARDS. Clin Chim Acta. 2000;298(1- 2):111-20.
- 10. Gutteridge JM, Quinlan GJ, Yamamoto Y. Hypothesis: are fatty acid patterns characteristic of essential fatty acid deficiency indicative of oxidative stress? Free Radic Res. 1998;28(2):109-14.
- 11. Zhu S, Ware LB, Geiser T, Matthay MA, Matalon S. Increased levels of nitrate and surfactant protein a nitration in the pulmonary edema fluid of patients with acute lung injury. Am J Respir Crit Care Med. 2001;163(1):166-72.
- 12. Sittipunt C, Steinberg KP, Ruzinski JT, Myles C, Zhu S, Goodman RB, et al. Nitric oxide and nitrotyrosine in the lungs of patients with acute respiratory distress syndrome. Am J Respir Crit Care Med. 2001;163(2):503-10.
- 13. Kawabata K, Hagio T, Matsuoka S. The role of neutrophil elastase in acute lung injury. Eur J Pharmacol. 2002;451(1):1-10. Review.
- 14. Kuan YH, Lin RH, Chen YL, Tsao LT, Tzeng CC, Wang JP. Effective attenuation of acute lung injury in vivo and the formyl peptide-induced neutrophil activation in vitro by CYL-26z through the phosphoinositide 3-kinase gamma pathway. Biochem Pharmacol. 2006;72(6):749-60.
- 15. Petronilho F, Constantino L, de Souza B, Reinke A, Martins MR, Fraga CM, et al. Efficacy of the combination of N-acetylcysteine and desferrioxamine in the prevention and treatment of gentamicin-induced acute renal failure in male Wistar rats. Nephrol Dial Transplant. 2009;24(7):2077-82.
- 16. Lee WL, Downey GP. Neutrophil activation and acute lung injury. Curr Opin Crit Care. 2001;7(1):1-7. Review.
- 17. Nohl H, Gille L, Staniek K. Intracellular generation of reactive oxygen species by mitochondria. Biochem Pharmacol. 2005;69(5):719-23.
- 18. Crimi E, Sica V, Williams-Ignarro S, Zhang H, Slutsky AS, Ignarro LJ, Napoli C. The role of oxidative stress in adult critical care. Free Radic Biol Med. 2006;40(3):398-406.
- 19. Moradi M, Mojtahedzadeh M, Mandegari A, Soltan-Sharifi MS, Najafi A, Khajavi MR, et al. The role of glutathione- S-transferase polymorphisms on clinical outcome of ALI/ ARDS patient treated with N-acetylcysteine. Respir Med. 2009;103(3):434-41.
- 20. Pontes-Arruda A, Aragão AM, Albuquerque JD. Effects of enteral feeding with eicosapentaenoic acid, gammalinolenic acid, and antioxidants in mechanically ventilated patients with severe sepsis and septic shock. Crit Care Med. 2006;34(9):2325-33.
- 21. Rahman I, MacNee W. Regulation of redox glutathione levels and gene transcription in lung inflammation: therapeutic approaches. Free Radic Biol Med. 2000;28(9):1405-20.
- 22. Rahman I. Regulation of glutathione in inflammation and chronic lung diseases. Mutat Res. 2005;579(1-2):58-80.
- 23. Koksel O, Cinel I, Tamer L, Cinel L, Ozdulger A, Kanik A, et al. N-acetylcysteine inhibits peroxynitrite-mediated damage in oleic acid-induced lung injury. Pulm Pharmacol Ther. 2004;17(5):263-70.
- 24. Fan J, Shek PN, Suntres ZE, Li YH, Oreopoulos GD, Rotstein OD. Liposomal antioxidants provide prolonged protection against acute respiratory distress syndrome. Surgery. 2000;128(2):332-8.
- 25. Mitsopoulos P,Suntres, P. Cytotoxity and gene array analysis of alveolar epithelial A549 cells exposed to paraquat. Chem Biol Interact. 2010;188(3):427-36.
- 26. Arita Y, Kazzaz JA, Joseph A, Koo HC, Li Y, Davis JM. Antioxidants improve antibacterial function in hyperoxia-exposed macrophages. Free Radic Biol Med. 2007;42(10):1517-23.
- 27. Bernard GR, Wheeler AP, Arons MM, Morris PE, Paz HL, Russell JA, Wright PE. A trial of antioxidants N-acetylcysteine and procysteine in ARDS. The Antioxidant in ARDS Study Group. Chest. 1997;112(1):164-72.
- 28. Nathens AB, Neff MJ, Jurkovich GJ, Klotz P, Farver K, Ruzinski JT, et al. Randomized, prospective trial of antioxidant supplementation in critically ill surgical patients. Ann Surg. 2002;236(6):814-22.
- 29. Manzanares Castro W. [Selenium in critically ill patients with systemic inflammatory response]. Nutr Hosp. 2007;22(3):295-306.
Datas de Publicação
-
Publicação nesta coleção
02 Maio 2011 -
Data do Fascículo
Mar 2011
Histórico
-
Recebido
05 Nov 2010 -
Aceito
01 Mar 2011

 Suplementação de antioxidantes no tratamento da lesão pulmonar aguda: meta-análise
Suplementação de antioxidantes no tratamento da lesão pulmonar aguda: meta-análise